Co to jest tlen? Związki tlenu
Oksygen (O) jest niemetalicznym pierwiastkiem chemicznym grupy 16 (VIa) układu okresowego. Jest to bezbarwny, bez smaku i bez zapachu gaz niezbędny dla organizmów żywych – zwierzęta przekształcające je w dwutlenek węgla oraz rośliny, które wykorzystują CO2 jako źródło węgla i powracają O2 do atmosfery. Tlen tworzą związki reagujące praktycznie z każdym innym pierwiastkiem, a także wyrzucają elementy chemiczne ze sobą. W wielu przypadkach procesom tym towarzyszy odprowadzanie ciepła i światła. Najważniejszym związkiem tlenu jest woda.

Historia odkrycia
W 1772 r. Szwedzki chemik Karl Wilhelm Scheele po raz pierwszy wykazał, czym jest tlenu, uzyskując to poprzez podgrzanie azotanu potasu, tlenku rtęci i wielu innych substancji. Niezależnie od niego w 1774 r. Angielski chemik Joseph Priestley odkrył ten pierwiastek chemiczny w wyniku termicznego rozkładu tlenku rtęci i opublikował wyniki tego samego roku, trzy lata przed publikacją Scheele. W latach 1775-1780 francuski chemik Antoine Lavoisier interpretował rolę tlenu w oddychaniu i spalaniu, odrzucając teorię fogistonu, powszechnie akceptowaną w tym czasie. Zauważył skłonność do tworzenia kwasów w połączeniu z różnymi substancjami i nazwał pierwiastek oksygenu, co w języku greckim oznacza "dawanie kwasu".

Rozpowszechnienie
Co to jest tlen? Udział w niej 46% masy skorupy ziemskiej jest jego najczęstszym składnikiem. Ilość tlenu w atmosferze wynosi 21% objętościowo, a w wodzie morskiej 89%.
W skałach element ten łączy się z metalami i niemetalami w postaci tlenków, które są kwasowe (na przykład siarka, węgiel, glin i fosfor) lub zasadowe (sole wapnia, magnezu i żelaza) oraz jako związki soli, które można uznać za utworzone z kwaśnych kwasów I podstawowe tlenki, takie jak siarczany, węglany, krzemiany, glinany i fosforany. Chociaż są liczne, ale te ciało stałe nie mogą służyć jako źródło tlenu, ponieważ złamanie więzi między elementem a atomami metalu jest zbyt energochłonne.
Funkcje
Jeśli temperatura tlenu jest niższa niż -183 ° C, staje się jasnobłękitną cieczą iw temperaturze -218 ° C jest stała. Czysty O 2 jest 1,1 razy cięższy od powietrza.
Podczas oddychania zwierzęta i niektóre bakterie zużywają tlen z atmosfery i zwracają dwutlenek węgla, podczas gdy w procesie fotosyntezy rośliny zielone absorbują dwutlenek węgla w obecności światła słonecznego i uwalniają wolny tlen. Prawie wszystkie O2 w atmosferze powstają w wyniku fotosyntezy.
W temperaturze 20 ° C w 100 częściach słodkiej wody rozpuszcza się około 3 części objętościowych tlenu, nieco mniej w wodzie morskiej. Jest to niezbędne do oddychania ryb i innych morskich.
Naturalny tlen jest mieszaniną trzech trwałych izotopów: 16 O (99,759%), 17 O (0,037%) i 18 O (0,204%). Znane jest kilka sztucznie otrzymanych radioaktywnych izotopów. Najdłuższym z nich jest 15 O (z okresem półtrwania 124 s), który jest używany do badania oddychania u ssaków.

Allotropy
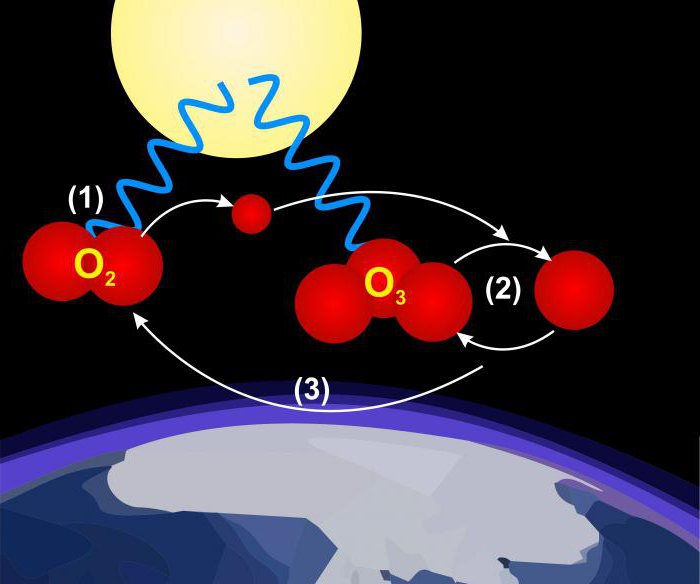
Bardziej wyraźnym pomysłem na to, co tlenu, można uzyskać dwie formy allotropowe, ziemia okrzemkowa (O2) i triatomiczny (O3, ozon). Właściwości formy diatomicznej sugerują, że sześć elektronów wiąże atomy, a dwa pozostają nierozłączone, powodując paramagnetyzm tlenu. Trzy atomy w cząsteczce ozonu nie znajdują się na tej samej linii prostej.
Ozon można otrzymać zgodnie z równaniem: 3O 2 → 2O 3 .
Proces ten jest endotermiczny (wymaga wydatków na energię); Konwersja ozonu z powrotem do tlenu dwuatomowego jest ułatwiona przez obecność metali przejściowych lub ich tlenków. Czysty tlen przekształca się w ozon pod wpływem rozżarzonego elektrycznego rozładowania. Reakcja zachodzi również, gdy ultrafiolet jest pochłanczony o długości fali około 250 nm. Powstanie tego procesu w górnych warstwach atmosfery eliminuje promieniowanie, które może uszkodzić życie na powierzchni Ziemi. Zapach ozonu jest obecny w zamkniętych pomieszczeniach za pomocą urządzeń elektrycznych, takich jak generatory. Ten gaz jest jasnoniebieski. Jego gęstość jest 1.658 razy większa od powietrza i ma temperaturę wrzenia -112 ° C pod ciśnieniem atmosferycznym.
Ozon jest silnym utleniaczem zdolnym do przekształcania dwutlenku siarki w trójtlenek, siarczek w siarczan, jodek do jodu (zapewniający analityczną metodę jego oceny) oraz wiele związków organicznych w pochodnych zawierających tlen, takich jak aldehydy i kwasy. Powodem smogu jest konwersja ozonu węglowodorów z spalin do tych kwasów i aldehydów. W przemyśle ozon jest stosowany jako odczynnik chemiczny, środek dezynfekujący, do oczyszczania ścieków, uzdatniania wody i bielenia tkanek.
Metody uzyskiwania
Sposób wytworzenia tlenu zależy od ilości gazu. Metody laboratoryjne są następujące:
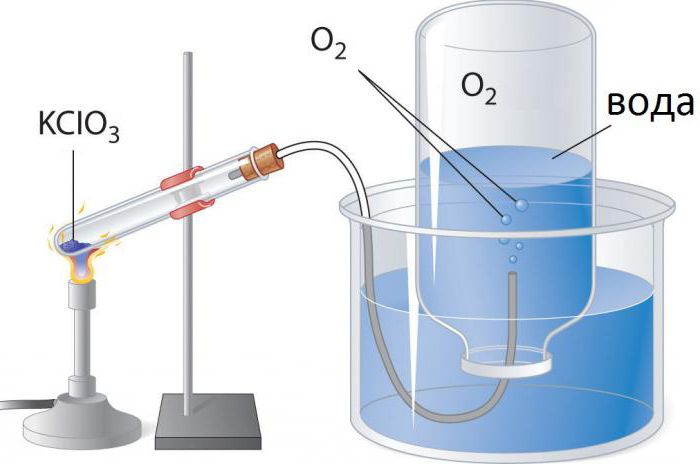
1. Termiczny rozkład pewnych soli, takich jak chloran potasu lub azotan potasu:
- 2KClO3 → 2KCl + 3O2.
- 2KNO3 → 2KNO2 + O2.
Rozkład chloranu potasu katalizuje się tlenkami metali przejściowych. W tym celu często stosuje się dwutlenek manganu (pirolusyt, MnO2). Katalizator redukuje temperaturę potrzebną do uwalniania tlenu w temperaturze od 400 do 250 ° C.
2. Rozkład tlenków metali pod wpływem temperatury:
- 2HgO> 2Hg + O2.
- 2Ag 2O → 4Ag + O2.
Scheele i Priestley stosowali ten związek (tlenek) tlenu i rtęci (II) w celu uzyskania tego pierwiastka chemicznego.
3. Termiczny rozkład nadtlenków metali lub nadtlenku wodoru:
- 2BaO + O2> 2BaO2.
- 2BaO 2 → 2BaO + O2.
- BaO 2 + H 2S04 → H 2O 2 + BaS04.
- 2H 2O 2 → 2H 2O + O 2.
Pierwsze przemysłowe metody oddzielania tlenu od atmosfery lub wytwarzania nadtlenku wodoru zależały od tworzenia nadtlenku baru z tlenku.
4. Elektroliza wody o małych zanieczyszczeniach soli lub kwasów, które zapewniają przewodność elektryczną:
2H 2O → 2H 2 + 0
Produkcja przemysłowa
Jeśli konieczne jest uzyskanie dużej ilości tlenu, stosuje się destylację frakcjonowaną ciekłego powietrza. Z głównych składników powietrza ma najwyższy punkt wrzenia i dlatego jest mniej lotny niż azot i argon. W trakcie gaz jest chłodzony podczas rozszerzania. Główne etapy działania są następujące:
- Powietrze jest filtrowane w celu usunięcia substancji stałych;
- Wilgoć i dwutlenek węgla usuwa się przez wchłanianie w alkaliach;
- Powietrze jest sprężone, a ciepło sprężania jest usuwane za pomocą konwencjonalnych procedur chłodzenia;
- Następnie wchodzi do kręgu w komorze;
- Część sprężonego gazu (pod ciśnieniem około 200 atm) rozszerza się w komorze, chłodząc cewkę;
- Spieniony gaz powraca do sprężarki i przechodzi kilka etapów późniejszego rozprężania i sprężania, tak że w temperaturze -196 ° C powietrze staje się cieczą;
- Ciecz jest podgrzewana w celu oddestylowania pierwszych gazów obojętnych, a następnie azotu i ciekłego tlenu. Wielokrotne frakcjonowanie prowadzi do bardzo czystego produktu (99,5%) dla większości celów przemysłowych.
Zastosowanie w przemyśle
Metalurgia jest największym konsumentem czystego tlenu do produkcji stali wysokowęglowej: pozbycie się dwutlenku węgla i innych zanieczyszczeń niemetalicznych jest szybsze i łatwiejsze niż użycie powietrza.
Oczyszczanie ścieków za pomocą tlenu obiecuje skuteczniejsze oczyszczanie płynnych ścieków niż w innych procesach chemicznych. Coraz ważniejsze staje się spalanie odpadów w systemach zamkniętych przy użyciu czystego O 2 .
Tak zwanym utleniaczem rakietowym jest ciekły tlen. Czysty O2 jest używany na okręty podwodne i dzwony do nurkowania.
W przemyśle chemicznym tlenu zastępuje konwencjonalne powietrze w produkcji substancji takich jak acetylen, tlenek etylenu i metanol. Do zastosowań medycznych należą użycie gazu w komórkach tlenowych, inhalatorów i inkubatorów dla dzieci. Wzbogacony tlenem środek znieczulający gaz zapewnia wsparcie podczas znieczulenia ogólnego. Bez tego pierwiastka chemicznego wiele gałęzi przemysłu stosujących piece topiące nie mogło istnieć. To jest tlen.

Właściwości chemiczne i reakcje
Duże wielkości elektroujemności i powinowactwa do tlenu są typowe dla elementów, które wykazują właściwości niemetaliczne. Wszystkie związki tlenu mają negatywny stan utleniania. Gdy dwa orbitale są wypełnione elektronami, tworzy się jon O2. W nadtlenkach (O2 2- ) przyjmuje się, że każdy atom ma ładunek -1. Ta właściwość akceptuje elektrony przez pełne lub częściowe przenoszenie i określa środek utleniający. Gdy taki środek reaguje z substancją dawcy elektronu, jego własny stan utleniania maleje. Zmiana (spadek) stanu utleniania tlenu od zera do -2 nazywa się odzyskiwaniem.
W normalnych warunkach element tworzy związki dwuatomowe i triatomiczne. Ponadto istnieją niezwykle niestabilne cząsteczki tetrahalowe. W formie dwuatomowej dwa niesparowane elektrony są zlokalizowane na orbitalach niewiązanych. Potwierdzają to paramagnetyczne zachowanie gazu.
Intensywność reaktywności ozonu jest czasami wyjaśniona przez założenie, że jeden z trzech atomów znajduje się w stanie "atomowym". Po reakcji, atom ten oddziela się od O 3 , pozostawiając tlen cząsteczkowy.
Cząsteczka O2 jest słabo reaktywna w normalnych temperaturach i ciśnieniach otoczenia. Tlen atomowy jest o wiele bardziej aktywny. Energia dysocjacji (O2 + 2O) jest znacząca i wynosi 117,2 kcal na mol.

Połączenia
W przypadku niemetali, takich jak wodór, węgiel i siarkę, tlen tworzy duży związek związany kowalencyjnie, wśród których są tlenki niemetaliczne, takie jak woda (H2O), dwutlenek siarki (SO 2 ) i dwutlenek węgla (CO 2 ); Związki organiczne, takie jak alkohole, aldehydy i kwasy karboksylowe; Typowe kwasy, takie jak węgiel (H 2CO 3 ), siarkowe (H2S04) i azotowe (HNO3); I odpowiednie sole, takie jak siarczan sodu (Na2SO4), węglan sodu (Na2CO3) i azotan sodu (NaNO3). Tlen jest obecny jako jon O2 w krystalicznej strukturze tlenków metali stałych, takich jak związek tlenowy (tlenek) i wapń CaO. Nadtlenki metali (KO2) zawierają jony O2 – jodu, natomiast nadtlenki metali (BaO2) zawierają jon O2-2. Związki tlenowe mają ogólnie stan utleniania -2.
Podstawowe właściwości
Na koniec wymieniamy główne właściwości tlenu:
- Konfiguracja elektronów: 1s 2 2s 2 2p 4 .
- Liczba atomowa: 8.
- Masa atomowa: 15,9994.
- Temperatura wrzenia: -183,0 ° C.
- Temperatura topnienia: -218,4 ° C.
- Gęstość (jeśli ciśnienie tlenu wynosi 1 atm przy 0 ° C): 1,429 g / l.
- Stany utleniania: -1, -2, +2 (w związkach z fluorem).