Właściwości fizyczne i chemiczne siarki
Siarka – dość powszechne w przyrodzie pierwiastka chemicznego (zawartość XVI w skorupie ziemskiej, a szósty – w wodach naturalnych). Są to zarówno rodzimy siarki (stan wolny pierwiastek) i jego połączenia.

Siarki w przyrodzie
Wśród najważniejszych minerały naturalne siarki można nazwać piryt żelazo, sfaleryt, galena, cynober, antymonitu. Oceany zawierał głównie w postaci siarczanów wapnia, magnezu i sodu powoduje sztywność wód naturalnych.
Jak zdobyć siarkę?
Ekstrakcja rudy siarki z różnych metod. Główną metodą siarki jest jego wytapiania bezpośrednio in situ.
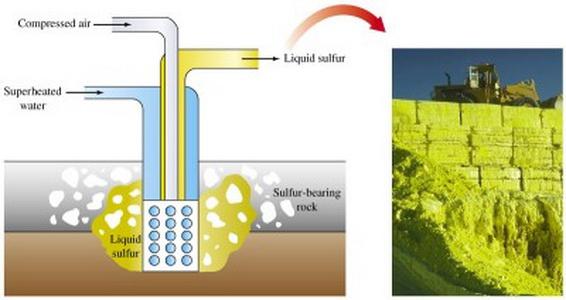
Metoda otwartej górniczych wymaga użycia koparki, usunięcie warstw skały płonnej, które obejmują siarkowy rudy. Po kruszeniu rozerwania szwu rudy skierowane ich seroplavilny roślin.
W przemyśle, siarki otrzymuje się jako produkt uboczny z procesów w piecach do topienia, przy rafinacji. W dużych ilościach, jest on obecny w gazie ziemnym (w postaci dwutlenku siarki i siarkowodoru), w którym następuje ekstrakcja osadza się na ściankach urządzenia wykorzystywane. Uwięziony gaz z siarki stosuje się w drobno przemyśle chemicznym jako surowce do wytwarzania różnych produktów.
Materiał można wytwarzać z naturalnych i dwutlenku siarki. Aby to zrobić, należy użyć metody Claus. Polega ona na stosowaniu „wgłębień siarki”, w których zachodzi odgazowanie siarki. Wynikiem jest zmodyfikowaną siarki są szeroko stosowane przy produkcji asfaltu.
Podstawową modyfikacją alotropowa siarki
Siarka nieodłącznym alotropia. Wiele z alotropowych modyfikacji. Najbardziej znane są rombowej (krystalicznego), jednoskośny (igły) i tworzyw sztucznych na bazie siarki. Pierwsze dwie modyfikacje są stabilne, trzeci podczas krzepnięcia jest przekształcany w kształcie rombów.

Właściwości fizyczne charakteryzujące siarki
Cząsteczki rombowego (α-S) i p-jednoskośnej (S) zawierają modyfikacje 8 atomów siarki, które są połączone w zamkniętą pętlę pojedynczych wiązań kowalencyjnych.
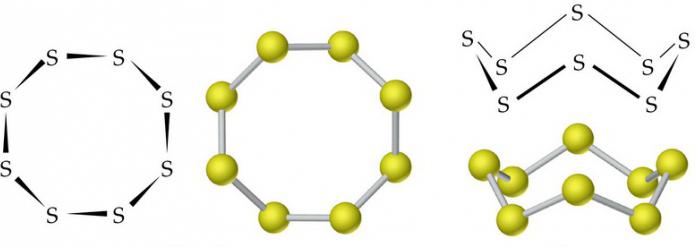
W normalnych warunkach, siarka ma modyfikację rombowy. To żółte krystaliczne ciało stałe o gęstości 2,07 g / cm3. Topi się w 113 ° C Jednoskośny gęstość siarki 1,96 g / cm3, jej temperatura topnienia wynosi 119,3 ° C,
Podczas topienia zwiększa się siarkę w ilości oraz się żółtą ciecz, która brązowieje w temperaturze 160 ° C przekształca się w postaci lepkiej ciemno brązowej masy po osiągnięciu 190 ° C, W temperaturach powyżej tej wartości lepkości siarki zmniejsza się. W temperaturze około 300 ° C ponownie przechodzi w stan płynny stan płynny. Jest tak, ponieważ w procesie ogrzewania polimeryzuje siarki, wraz ze wzrostem temperatury wzrostem długości łańcucha. A gdy wartość temperatury ponad 190 ° C nie jest zniszczenie polimeryzację.

Po ochłodzeniu do roztopionej siarki naturalnie utworzone w walcowych tygli tzw bryła siarki – rombowych kryształów o dużych rozmiarach, o zniekształcony kształt ośmiościanów o częściowo „cut” krawędzie lub narożniki.
Jeśli stopiony materiał poddaje się hartowaniu (na przykład, za pomocą zimnej wody), to jest możliwe, w celu uzyskania plastycznego siarki jest sprężysty gumowata masa brązowy lub ciemno-czerwony kolor, o gęstości 2.046 g / cm3. Modyfikacja ta, w przeciwieństwie do rombowej i jednoskośnej jest niestabilny. Powoli (przez kilka godzin), zmienia kolor na żółty, staje się kruchy i zamienia się w kształcie rombów.
Przy zamrażaniu oparów siarki, (bardzo wysokich), ciekłe postacie azotu purpurea modyfikacja, która jest stabilna w temperaturach poniżej -80 ° C,
Ośrodek wodny jest praktycznie nierozpuszczalny siarki. Jednak charakteryzują się dobrą rozpuszczalnością w rozpuszczalnikach organicznych. Złym przewodnikiem elektryczności i ciepła.
Temperatura wrzenia siarki wynosi 444,6 ° C, procesu towarzyszy uwolnienie pomarańczowo-żółty oparów składających się głównie z S 8 cząsteczek dysocjują na późniejszym ogrzewaniu, powodując tworzenie równowagi wrzenia tworzy S 6, S 4 i S2. Ponadto, podczas ogrzewania rozkłada się duże cząsteczki, w temperaturze powyżej 900 ° pary składają się zasadniczo z S2 do dysocjacji cząsteczek węgla w temperaturze 1500 ° C,
Co ma właściwości chemiczne siarki?
Siarka jest typowy dla metalu. Chemicznie aktywne. Utlenianie – redukcja siarki właściwości są przedstawione w odniesieniu do kilku elementów. Po podgrzaniu, może być łatwo połączone z niemal wszystkich elementów, co wyjaśnia jego obowiązkową obecność rud metali. Wyjątkiem jest sytuacja, Pt, Au, I2, N2 oraz gazy szlachetne. Utleniania, która przejawia się w związki siarki, -2, +4, +6.
Właściwości siarki i tlenu powoduje powietrze do spalania. Wynikiem tego oddziaływania jest powstawanie ditlenku siarki (SO2) i siarki (SO3), bezwodniki stosuje się w celu wytworzenia kwasów siarkowe i kwas siarkowy.
W temperaturze pokojowej, własności redukujące siarkę przejawia się jedynie w odniesieniu do atomu fluoru w reakcji, która tworzy sześciofluorek siarki :
- S + 2 3F = SF6.
Podczas ogrzewania (w stopie) poddaje się reakcji z chlorem, fosforu, krzemu, węgla. Reakcje z siarkowodoru formy addycyjne wodoru sulfan w połączeniu o wzorze ogólnym H2S H.
Właściwości utleniania siarki obserwowane przez reakcję z metalami. W niektórych przypadkach można zaobserwować dość silną reakcję. Interakcja siarczków metali, tworzonych (związki siarki) i polisiarczków (metali mnogosernistye).
Przedłużone ogrzewanie reakcji z mocnymi kwasami, utleniaczy, przy czym utlenione.
Następnie pod podstawowe właściwości związków siarki.
dwutlenek siarki
tlenek siarki (IV), określany również jako dwutlenek siarki i bezwodnika siarkawego, to gaz (bezbarwne) z ostrym duszące zapachu. To wydaje się być skroplone pod ciśnieniem w temperaturze pokojowej. SO2 jest tlenek kwasowy. Charakteryzuje się on dobrą rozpuszczalnością w wodzie. W ten sposób powstaje niestabilny, słabo kwas siarkowy, który występuje tylko w roztworze wodnym. Reakcję dwutlenku siarki z siarczyny metali alkalicznych osad.
Ma dość dużą aktywność chemiczną. Najbardziej widoczne są właściwości chemicznej redukcji tlenek siarki (IV). Takie reakcje towarzyszy wzrost stopnia utlenienia siarki.
Utleniające właściwości chemiczne przejawia tlenek siarki w obecności silnych środków redukujących (na przykład, tlenek węgla).
trójtlenek siarki
tritlenek siarki (dwutlenek siarki) – najwyższe tlenku siarki (VI). W normalnych warunkach, to jest w postaci bezbarwnej cieczy o lotny duszności zapach. To skłania do zamrażania przy wartościach temperatury niższej niż 16,9 ° C. W tym przypadku, mieszanina różnych modyfikacjach krystalicznych stałego trójtlenku siarki. tlenku siarkę właściwości higroskopijnych powoduje jej „dymlenie” w warunkach wilgotnego powietrza. W wyniku tego, powstawanie kropelek kwasu siarkowego.
siarkowodór
Siarkowodór jest binarny związek chemiczny z grupy obejmującej atom wodoru i siarki. H2S – jest toksycznym bezbarwnym gazem, którego cechami charakterystycznymi są: słodki smak i zapach zgniłych jaj. Topnieje w temperaturze minus 86 ° C i wrze w temperaturze -60 ° C, Termicznie niestabilne. Wartości w temperaturze wyższej niż 400 ° C, powoduje rozkład siarkowodoru do S i H2. Charakteryzuje się dobrą rozpuszczalność w etanolu. Woda rozpuszcza się słabo. W wyniku rozpuszczania w wodzie tworzy siarkowodoru słaby kwas. Siarkowodór jest silny środek redukujący.

Łatwopalny. W swojej powietrza do spalania można obserwować niebieski płomień. W wysokich stężeniach może reagować z wieloma metalami.
kwas siarkowy
Kwas siarkowy (H 2SO 4) może mieć rozmaite stężenia i czystości. Stan bezwodny jest bezbarwna oleista ciecz o nie ma zapachu.
temperaturę, w której substancja jest topiony, 10 ° C Temperatura wrzenia wynosi 296 ° C, Woda dobrze rozpuszcza się. Gdy jest rozpuszczony siarkowy tworzy hydratów kwasu, o dużej ilości ciepła. Temperatura wrzenia wodnych roztworów przy ciśnieniu 760 mm Hg. Art. większa niż 100 ° C, Zwiększenie temperatury wrzenia pojawia się wraz ze wzrostem stężenia kwasu.
Kwasowo materiału pojawia się w interakcję z zasadowych tlenków i zasad. H 2SO 4 jest dikwasem, a tym samym mogą stanowić siarczanów (medium sole) oraz hydrosulfates (sól kwasowa), z których większość jest rozpuszczalna w wodzie.
Jest to szczególnie wyraźnie przejawia Właściwości kwasu siarkowego w reakcjach redox. Wynika to z faktu, że kompozycja H2 SO4 na najwyższym stopniu utlenienia siarki (6). Jako przykład objawy właściwościach utleniających, kwasu siarkowego, można prowadzić reakcję z miedzi:
- Cu + 2 H 2SO 4 = CuSO 4 + 2H 2O + SO2.
Siarka: właściwości użytkowe
Siarka jest pierwiastkiem śladowym niezbędne dla żywych organizmów. Jest to część aminokwasów (metioniny i cysteiny), enzymów i witamin. Element ten jest zaangażowana w tworzeniu trzeciorzędowej struktury białka. Ilość chemicznie związanej siarki zawarte w białkach, to wagowo od 0,8 do 2,4%. Zawartość pierwiastka w organizmie człowieka wynosi około 2 g na 1 kg wagi (to jest, około 0,2% wagowych siarki).
Przydatne właściwości pierwiastka śladowego jest nie do przecenienia. Ochrona protoplazmy krwi, siarka jest aktywnym asystentem organizmu w zwalczaniu szkodliwych bakterii. To zależy od ilości krzepnięcia, że jest to element pomaga utrzymać odpowiedni poziom. Siarka odgrywa również rolę w utrzymaniu prawidłowego poziomu koncentracji żółci wytwarzanej przez organizm.
„Beauty mineralny” jest często nazywany, ponieważ jest to absolutnie konieczne, aby zachować zdrowie skóry, włosów i paznokci. Siarka nieodłączną zdolność do ochrony organizmu przed różnego rodzaju negatywnego wpływu na środowisko. To pomaga spowolnić proces starzenia. Siarka oczyszcza organizm z toksyn i chroni przed promieniowaniem, co jest szczególnie ważne teraz, biorąc pod uwagę obecną sytuację na środowisko.
Niewystarczające ilości pierwiastków śladowych w organizmie może prowadzić do słabego usuwania toksyn obniżonej odporności i żywotności.
Siarka – uczestnik fotosyntezy bakteryjnej. Jest składnikiem bakteriochlorofilu i siarczku wodoru – źródło wodoru.
Sera: właściwości i zastosowania w przemyśle
Najszerzej stosowane siarki do wytwarzania kwasu siarkowego. Ponadto właściwości tego materiału, umożliwia jej wykorzystanie do wulkanizacji kauczuku, jak środki grzybobójcze w rolnictwie i nawet leku (koloid siarki). Ponadto, siarka jest wykorzystywane do produkcji zapałek pirotechniczne kompozycji jest częścią do wytwarzania kompozycji serobitumnyh seroasfalta.