Metaliczny spoiwo: mechanizm formacji. Metal Chemical Communication:
Wszystkie znane obecnie pierwiastki chemiczne w okresowym arbitralnie podzielono na dwie grupy: metali i niemetali. W celu aby się nie tylko elementy i związki chemiczne mogą reagować ze sobą, powinny one występować w postaci prostych i złożonych związków.
To dlatego niektóre elektrony starają się przyjąć, a drugi – aby dać. Uzupełnianie ze sobą tak, że tworzą różne elementy i cząsteczek chemicznych. Ale to, co pozwala im się odbyć razem? Dlaczego jest taka kwestia siły, aby zniszczyć, która przekracza nawet najpoważniejsze instrumenty? I inni, przeciwnie, są niszczone przez najmniejszego wpływu. Wszystko to jest spowodowane powstawania różnych typów wiązania chemiczne między atomami w cząsteczkach, które stanowią konkretne struktury krystalicznej.
Rodzaje wiązań chemicznych w związkach
Razem można wyróżnić cztery główne typy wiązań chemicznych.
- Kowalencyjne niepolarne. Tworzy się pomiędzy dwoma identycznymi niemetali powodu podziału elektronów, tworząc wspólne pary elektronowej. W edukacji jest udział niesparowanych cząstek atomów. Przykłady: atomy chlorowców, tlen, wodór, azot, siarka, fosfor.
- Polar kowalencyjne. Tworzy się pomiędzy dwoma różnymi niemetali lub od bardzo słabych na właściwości metalu i niemetalu słaby elektroujemności. Bazowe i ogólne pary elektronów i pociągając je do niej, którego atom elektronów powinowactwo powyżej. Przykłady: NH3, SiC, P 2O 5 i innych.
- wiązanie wodorowe. Najbardziej niestabilne i słabe, jest utworzony pomiędzy atomem silnie elektroujemnym jednej cząsteczki, a drugi dodatni. Dzieje się najczęściej, gdy substancje rozpuszczone w wodzie (alkoholu, amoniaku i tak dalej). Dzięki takiemu połączeniu mogą występować białka makrocząsteczki, kwasy nukleinowe, węglowodany złożone, i tak dalej.
- Ionic bond. Tworzy się z powodu sił przyciągania elektrostatycznego raznozaryazhennyh jonów metali i niemetali. Im większa różnica tego wskaźnika, tym bardziej widoczny jest jonowy charakter oddziaływania. Przykłady związków: sól podwójną, związek kompleksowy – alkalicznych.
- Metaliczny wiązanie, w których mechanizm tworzenia i właściwości, które zostaną omówione dalej. Założony w metali, ich stopów różnego rodzaju.
Istnieje coś takiego jak jedność wiązania chemicznego. To po prostu mówi, że niemożliwe jest, aby rozważyć każdą benchmarku obligacji. wszystkie one są po prostu symbol jednostki. Po tym wszystkim, podstawą wszelkich oddziaływań jest pojedynczym zasada – elektronnostaticheskoe interakcji. W związku z tym, jonowe, metaliczny, wiązanie kowalencyjne i wodoru pojedynczą strukturę chemiczną i tylko przypadki graniczne siebie.
Metale i ich właściwości fizycznych
Metale znajdują się w zdecydowanej większości wszystkich pierwiastków chemicznych. To ze względu na ich szczególne właściwości. Znaczna część, który otrzymano przez osobę reakcjach jądrowych w laboratorium są promieniotwórcze o krótkim okresie półtrwania.
Jednak większość – są elementami formującymi cały skały i rud są częścią najważniejszych związków. To właśnie z powodu tych ludzi, nauczyłem się rzucać stopy i wytwarzają wiele znakomitych i ważnych produktów. To jest takie jak miedź, żelazo, aluminium, srebro, złoto, chrom, mangan, nikiel, cynk, ołów i inne.
Dla metali może identyfikować wspólny właściwości fizyczne, co tłumaczy powstawanie schemat metaliczny spoiny. Co to są te cechy?
- Ciągliwość i plastyczność. Wiadomym jest, że wiele metali można zwinąć w dół nawet do punktu folii (złota, aluminium). Z drugiej strony otrzymują drutu, metalowe elastyczne arkusze, wyroby zdolne zdeformowanych przez oddziaływania fizycznego, ale potem odzyskać od jego zakończenia. Są to cechy metali i nazywa plastyczność i ciągliwość. Powodem tej funkcji – rodzaj łącza metalu. Jony i elektrony w stosunku kryształ przesuwnej względem siebie bez rozkruszenia, co pozwala na zachowanie integralności całego budynku.
- Metaliczny połysk. To również wyjaśnia, wiązanie metaliczne, mechanizm formowania się jego cech i funkcji. A zatem, nie wszystkie cząstki są w stanie wchłonąć i odbijanie fal światła o tej samej długości. Atomy Większość metali oraz odzwierciedlają krótkofalowe promienie srebrzysty się zasadniczo jednorodny kolor biały, blado niebieskawy odcień. Wyjątkiem są miedź i złoto, ich kolor jest czerwono-żółty i czerwony, odpowiednio. Są w stanie odbijają promieniowanie dłuższej długości fali.
- Termicznej i przewodności elektrycznej. Właściwości te również wyjaśnić strukturę sieci krystalicznej, i tym, że jego powstawanie jest realizowany wiązań typu metalu. Ze względu na „gaz elektronów” poruszającego się w krysztale, prąd elektryczny i ciepło szybko i równomiernie ze wszystkich atomów i jonów i prowadzone przez metal.
- Stałą stanu skupienia w warunkach normalnych. Tutaj jedynym wyjątkiem jest rtęć. Wszystkie inne metale – koniecznie mocne, stałe połączenia, jak również ich stopów. Jest to również wynika z faktu, że obecność wiązania metal-metal. Mechanizm powstawania tego typu właściwości wiązania cząstek pełni potwierdzone.
To podstawowe cechy fizyczne metali, który opisuje i określa tworzenie wiązania metalicznego dokładnie schemacie. Odpowiednimi związkami takimi metoda atomów metalowych elementów, ich stopów. To jest dla nich stałym i stanie ciekłym.

Metaliczny typu wiązania chemicznego
Jaka jest jego funkcja? Chodzi o to, że taki związek nie jest utworzone przez jony raznozaryazhennyh a przyciągania elektrostatycznego, a nie ze względu na różnicę w ładunku ujemnego i dostępności wolnych par elektronowych. Tj jonowy metalowe wiązanie kowalencyjne mają kilka różnego rodzaju i specyficznych cząsteczek wiążących.
Wszystkie metale są nieodłączne cechy, takie jak:
- mała ilość elektronów w zewnętrznym poziomie energii (z wyjątkiem kilku wyjątkami, do których może być 6,7 i 8);
- Duży promień atomowej;
- niska energia jonizacji.
Wszystko to przyczynia się do łatwego oddzielenia niesparowane elektrony na zewnętrznej rdzenia. W tym przypadku wolne orbitale atomu pozostaje bardzo dużo. Schemat wiązania metalowego tylko wykazywać wiele nakładających się na siebie komórek różnych atomów orbitalnych między nimi, w wyniku których intracrystalline i tworzą wspólną przestrzeń. Służy elektrony z każdym atomem, które zaczynają się swobodnie wędrować w różnych częściach sieci krystalicznej. Okresowo, z których każda jest przymocowana do jonu w jednostce kryształów i przekształca je do atomu, wówczas oderwany ponownie, tworząc jony.
Tak więc, wiązanie metaliczne – wiązanie między atomami, jony i wolne elektrony całkowitej krystalicznej metalu. Chmura elektronów swobodnie przemieszczać się wewnątrz konstrukcji, określanych jako „gaz” elektronów. Wyjaśniono im, większość właściwości fizycznych metali i ich stopów.
Jak konkretnie realizuje metaliczny wiązanie chemiczne? Przykładami są różne. Rozważmy kawałek litu. Nawet jeśli przyjąć, że wielkość ziarna grochu, istnieją tysiące atomów. Więc wyobraźmy sobie, że każdy z tych tysięcy atomów daje elektrony walencyjne w jednej wspólnej przestrzeni krystalicznej. Jednocześnie, znając strukturę elektronową elementu, można zobaczyć liczbę wolnych orbitali. Na ich litu wynosi 3 (drugi poziom energii p-orbital). Trzy każdy atom dziesiątek tysięcy – to wspólnej przestrzeni wewnątrz kryształu, w którym „elektroniczny gazowy” porusza się swobodnie.

Substancja zawsze silna więź metaliczny. Po tym wszystkim, gaz elektronów nie pozwala kryształ spada, lecz zmienia się warstwy i następnie odzyskuje. To świeci ma pewną gęstość (zazwyczaj wysoka), topliwości, ciągliwość i plastyczność.
Gdzie indziej realizowany wiązania metalicznego? Przykłady substancji:
- metale jak proste konstrukcje;
- Wszystkie stopy metali ze sobą;
- wszystkie metale i ich stopy, w stanie ciekłym i stałym.
Konkretne przykłady są po prostu niesamowita ilość, ponieważ metal w układzie okresowym, ponad 80!
Metaliczny spoiwo: mechanizm tworzenie
Jeśli weźmiemy pod uwagę to, w ogólnym zarysie, główne punkty jakie opisano powyżej. Dostępność orbitali atomowych i elektronów łatwo oddzielić od jąder z powodu niskiej energii jonizacji – to główne warunki formowania tego rodzaju komunikacji. Tak więc, wydaje się, że jest realizowany pomiędzy następujących cząsteczek:
- węgla w sieci krystalicznej;
- wolnych elektronów, które były w wartościowości metalu;
- Jony w sieci krystalicznej.
Rezultat – wiązanie metaliczne. Mechanizm powstawania zwykle wyrażona za pomocą następującego zapisu: Me 0 – E – ↔ Me n +. Z wykresu Oczywiście, wszystkie cząstki metalowe są obecne w krysztale.
Kryształy same mogą mieć różne kształty. To zależy od materiału, z którymi mamy do czynienia.
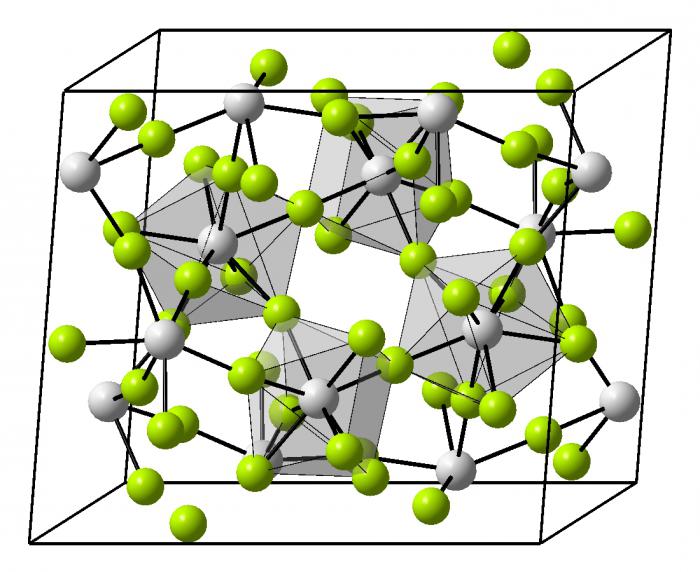
Rodzaje kryształów metali
Ta struktura z metalu lub jego stopu ma bardzo gęste upakowanie cząstek. Zapewnia jonów w miejscach kryształowe. Od siebie, sieć może być w różnych kształtach geometrycznych w przestrzeni.
- Obemnotsentricheskaya sieci regularnej – metali alkalicznych.
- Sześciokątny zwarta konstrukcja – wszystko alkaliczna, z wyjątkiem baru.
- Granetsentricheskaya Cubic – aluminium, miedź, cynk, że wiele metali przejściowych.
- Romboedrycznego struktura – rtęć.
- Czworokątny – ind.
Te metale ciężkie i dolna znajduje się w układzie okresowym, tym trudniej jest pakowanie i organizacja przestrzenna kryształu. Gdy stal ta wiązanie chemiczne, których przykłady można zmniejszyć do każdego istniejącego metalu ma decydujący wpływ na budowę kryształu. Stopy mają bardzo zróżnicowaną organizację w przestrzeni, niektóre z nich nadal nie są jeszcze w pełni poznany.

Dane komunikacyjne: nondirectionality
Wiązanie kowalencyjne i metalu jest bardzo wyraźną cechę charakterystyczną. W odróżnieniu od pierwszego, wiązanie metaliczne nie jest skierowana. Co to znaczy? Oznacza to, że chmura elektronów wewnątrz kryształu przesuwa się dość swobodnie w tym w różnych kierunkach, a każdy z Elektron jest w stanie przyłączyć się całkowicie każdą jonową w strukturę węzłów. Oznacza to, że interakcja odbywa się w różnych kierunkach. W związku z tym mówi się, że wiązanie metaliczne – bezkierunkowe.
Mechanizm wiązania kowalencyjnego obejmuje tworzenie wspólnych par elektronów, czyli chmury atomów zachodzą na siebie. I występuje wyłącznie na pewnej linii łączącej ich środki. Dlatego mówimy o kierunku takiego połączenia.
saturability
Cecha ta odzwierciedla zdolność węgla do ograniczonej lub nieograniczonej interakcji z innymi. Na przykład, wiązanie kowalencyjne i metali tego wskaźnika ponownie są przeciwstawne.
Pierwszym z nich jest pełna. Atomy udział w jej tworzeniu stała liczba zewnętrznych elektronów walencyjnych bezpośrednio zaangażowanych w powstawanie związku. Więcej niż jedzenie, to nie będzie elektrony. Dlatego liczba wiązań tworzą ograniczony wartościowość. W związku z tym w wyniku nasycenia. Ze względu na tę cechę większości związków ma stały skład chemiczny.
Wiązania metalowe i wodoru, a z drugiej strony, bez nasycania. Wynika to z wielu wolnych elektronów i orbitali w krysztale. Rola odgrywana przez jonów w miejscach sieci krystalicznej, z których każdy może być atomem i ponownie jon w dowolnym momencie.

Inną cechą wiązania metali – delokalizację wewnętrzny chmura elektronów. Przejawia się to w zdolności małej ilości elektronów wspólne połączyć wiele metali jąder atomowych. Oznacza to, że gęstość zdelokalizowany, jak to jest rozłożone równomiernie pomiędzy wszystkie jednostki w krysztale.
Przykłady tworzenia wiązania metalami
Rozważyć kilka konkretnych przykładów, które pokazują, jak wiązanie metaliczną powstaje. Przykłady W następujących substancji:
- cynk;
- aluminium;
- potasu;
- chrom.
tworzenie wiązania między atomami metalu cynku: 0 – 2e – ↔ Zn2 +. atom cynku ma cztery poziomy energii. Wolne orbitali w oparciu o strukturę elektronową, ma 15 – 3 orbitali p, 4 D 5 i 7 w 4F. Struktura elektroniczne obejmują: 1 s 2 2 2 2 2 p 6 3S 3p 6 4s 2 3d 10 4d 4p 0 0 0 4f tylko 30 elektronów atomu. Oznacza to, że dwie cząstki ujemne wolne wartościowości są w stanie poruszać się w 15 przestronnych i nikt nie zajmował orbitali. I tak każdy atom. W rezultacie – ogólne ogromne pustych przestrzeni składa się z orbit i małą ilość elektronów łączących ze sobą całą konstrukcję.
Wiązanie między atomami glinu metalicznego Al 0 – e – ↔ Al 3+. Trzynaście atomów elektrony aluminiowe zlokalizowane na trzech poziomach energetycznych, są one wyraźnie brakuje w obfitości. Struktura elektroniczne: 1 s 2 2 2 2p 6 3s 3p 1 2 0 3d. Darmowe orbitale – 7 sztuk. Oczywiście, chmura elektronów będą małe w porównaniu z całkowitą wewnętrznej wolnego miejsca w krysztale.

Chrom wiązanie metaliczne. Ten szczególny element ich struktury elektronowej. Po tym wszystkim, do stabilizowania usterki systemu z 4s elektronów do 3d orbitalnego: 1 s 2 2 2 6 2 2p 3S 4S 3p 6 1 5 4p 3d 4d 0 0 0 4F. Tylko 24 wartościowość elektronów, który jest sześć. Idą do wspólnej przestrzeni elektronicznej na tworzeniu wiązania chemicznego. Darmowe orbitale 15, który jest nadal znacznie wyższa niż wymagane do wypełnienia. W związku z tym, chrom – w typowy przykład metalu z odpowiednim wiązania w cząsteczce.
Jednym z najbardziej aktywnych metali, które reagują nawet zwykłą wodą na ogień jest potas. Co stanowi dla takich właściwości? Ponownie, w wielu aspektach – metaliczne typu wiązania. Elektrony w elemencie tylko 19, ale znajdują się one aż 4 poziomach energetycznych. To jest 30 różnych orbitali podpoziomów. Struktura elektroniczne: 1 s 2 2 2 6 2 2p 3S 4S 3p 6 1 0 4p 3d 4d 0 0 0 4F. Tylko dwa elektrony walencyjne o bardzo niskim zużyciu energii jonizacji. Swobodnie puścić i iść do wspólnej przestrzeni elektronicznej. Orbitale przenieść jeden atom części 22, to jest bardzo szeroki miejsca na „gaz” elektronów.
Podobieństwa i różnice w stosunku do innych rodzajów obligacji
Ogólnie rzecz biorąc, problem ten został już omówiony powyżej. Można jedynie uogólnić i wyciągnąć wniosek. Głównymi cechami wyróżniającymi wszystkie inne typy funkcji komunikacyjnych kryształów metali są:
- Kilka typów cząstek zaangażowanych w proces wiązania (atomów, jonów lub atomów jonów, elektronów);
- Różna przestrzenna struktura geometryczna kryształów.
Dzięki wodorowi i wiązaniu jonowym metal łączy nienasycenie i niekierunkowość. Z kowalencyjnym biegunowo – silnym przyciąganiem elektrostatycznym pomiędzy cząstkami. W odróżnieniu od jonów – typu cząstek w węzłach sieci krystalicznej (jonów). Z kowalencyjnymi atomami niepolarnymi w węzłach kryształu.
Rodzaje więzi metali różnych stanów zagregowanych
Jak już wspomniano powyżej, metalowe wiązanie chemiczne, którego przykłady podano w artykule, są utworzone w dwóch stanach agregatów metali i ich stopów: ciał stałych i ciekłych.
Powstaje pytanie: jaki rodzaj wiązania znajduje się w metalowej oparze? Odpowiedź: kowalencyjne polarne i niepolarne. Podobnie jak we wszystkich związkach w postaci gazu. Oznacza to, że kiedy metal jest podgrzewany przez długi czas i przenoszony z ciała stałego do ciekłego wiązania, struktura kryształu jest zachowana. Jednakże, jeśli chodzi o przenoszenie cieczy do stanu pary, kryształ zostaje zniszczony, a wiązanie metalu jest przekształcane w kowalencyjny.















