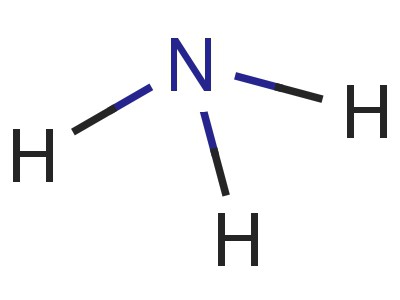
Wzór amoniaku. Wodorotlenek amonu jest wodnym roztworem amoniaku
Amoniak – azotek wodoru – jeden z najważniejszych związków azotu i wodoru. Jest to gaz bez barwy, ale o ostrym zapachu. Skład chemiczny odzwierciedla wzór amoniaku – NH3. Zwiększenie ciśnienia lub obniżenie temperatury substancji prowadzi do jego przekształcenia w bezbarwną ciecz. Amoniak gazowy i jego roztwory są szeroko stosowane w przemyśle i rolnictwie. W medycynie stosuje się 10% wodorotlenek amonu – amoniak.
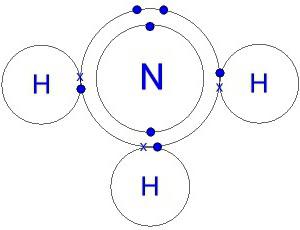
Struktura cząsteczki. Elektroniczna forma amoniaku
Cząsteczka azotku wodoru w formie przypomina piramidę, w której znajduje się azot, związana z atomami wodoru. Obligacje N-H są silnie spolaryzowane. Azot wiąże mocniej wiązkę elektronów. Zatem ładunek ujemny gromadzi się na atomach N, ładunek dodatni jest skoncentrowany na wodorze. Model cząsteczki, elektronicznej i strukturalnej formuły amoniaku, daje pojęcie o tym procesie.
Azotek wodoru bardzo dobrze się rozpuszcza w wodzie (700: 1 w temperaturze 20 ° C). Obecność praktycznie wolnych protonów prowadzi do powstawania licznych mostków wodorowych, które łączą cząsteczki razem. Właściwości struktury i wiązania chemicznego prowadzą również do tego, że amoniak łatwo ulega skropleniu przez zwiększenie ciśnienia lub obniżenie temperatury (-33 ° C).

Pochodzenie nazwy
Określenie "amoniak" zostało wprowadzone do praktyki naukowej w 1801 r. Pod sugestią rosyjskiego apteki Ya Zakharov, ale istota ludzkości jest znana z czasów starożytnych. Gazy o ostrym zapachu są uwalniane podczas rozkładu produktów o działaniu żywotnym, wielu związków organicznych, na przykład białek i mocznika, przy rozkładaniu soli amoniowych. Historycy chemii uważają, że substancja została nazwana po starożytnym Egipcie bogiem Amunem. W Afryce Północnej jest oaza Siwa (Ammon). Obok pustyni Libijskiej znajdują się ruiny starożytnego miasta i świątyni, obok których występują depozyty chlorku amonu. Ta substancja w Europie została nazwana solą Ammon. Jest legenda, że mieszkańcy Oasis Siva wchłonęli sól w świątyni.
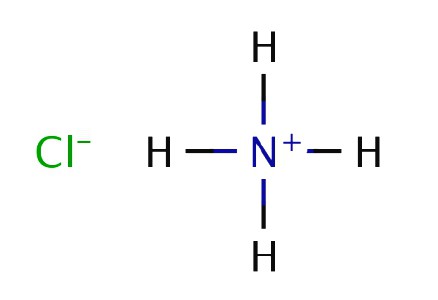
Przygotowanie azotku wodoru
Fizyk angielski i chemik Boyle spalili nawozów w eksperymentach i obserwowali tworzenie białego dymu nad kijem zanurzonym w kwasie chlorowodorowym i wprowadzonym do strumienia powstałego gazu. W 1774 r. Inny brytyjski chemik, D. Priestley, podgrzany chlorek amonu z wapnem hydratyzowanym i oddzielił gazową substancję. Priestley nazwał związek "alkalicznym powietrzem", ponieważ jego rozwiązanie wykazało właściwości słabej bazy. Wytłumaczono eksperyment Boyle'a, w którym amoniak był poddawany reakcji z kwasem chlorowodorowym. Stały biały chlorek amonu występuje wtedy, gdy cząsteczki reagujących substancji stykają się bezpośrednio z powietrzem.
Wzór chemiczny amoniaku został założony w 1875 roku przez Francuza C. Bertolle'a, który przeprowadził eksperyment na rozkład materii na komponenty kompozytowe pod wpływem wyładowania elektrycznego. Do tej pory eksperymenty z Priestley, Boyle i Berthollet były powielane w laboratoriach do produkcji azotków i chlorku amonu. Metoda przemysłowa została opracowana w 1901 przez A. Le Chateliera, który otrzymał patent na metodę syntezy materii z azotu i wodoru.
Roztwór amoniaku. Wzór i właściwości
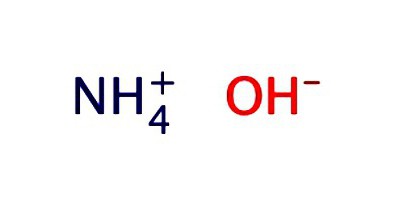
Wodny roztwór amoniaku jest zwykle rejestrowany w postaci wodorotlenku – NH4OH. Pokazuje właściwości słabego alkalicznego:
- Rozdziela się na jony NH3 + H20 = NH4OH = NH4 + + OH – ;
- Kolor roztworu fenoloftaleiny w kolorze karmazynowym;
- Działa z kwasami tworząc sól i wodę;
- Wytrąci Cu (OH) 2 w postaci jasnobłękitnej substancji po zmieszaniu z rozpuszczalną solą miedzi.
Równowaga w reakcji amoniaku z wodą przesuwa się w kierunku materiałów wyjściowych. Ogrzany azotek wodoru spala dobrze w tlenie. Utlenianie azotu zachodzi w przypadku cząsteczek dwuatomowych prostej materii N2. W reakcji z tlenkiem miedzi (II) objawia się również właściwości redukujące amoniaku.

Wartość amoniaku i jego roztworów
Azotek wodoru jest używany do produkcji soli amonowych i kwasu azotowego, jednego z najważniejszych produktów przemysłu chemicznego. Amoniak służy jako surowiec do produkcji sody (według metody azotanowej). Zawartość azotku wodoru w przemysłowym stężonym roztworze wynosi 25%. W rolnictwie stosuje się wodny roztwór amoniaku. Wzór chemiczny nawozu to NH4OH. Substancja jest bezpośrednio stosowana jako wierzchnie opatrunek. Innymi sposobami wzbogacania gleb w azot są sole amonowe: azotany, chlorki, fosforany. W warunkach przemysłowych i w gospodarstwach rolnych nie zaleca się przechowywania nawozów mineralnych zawierających sole amonowe z alkaliami. Jeśli integralność opakowania jest naruszona, substancje mogą reagować ze sobą w celu utworzenia amoniaku i uwolnienia go do powietrza pomieszczeń. Związek toksyczny wpływa niekorzystnie na układ oddechowy, ośrodkowy układ nerwowy człowieka. Mieszanka amoniaku i powietrza jest wybuchowa.