Alkany, alkeny, alkiny – to organiczne substancje chemiczne. Wszystkie z nich są zbudowane z takich pierwiastków chemicznych takich jak węgiel i wodór. Alkany, alkeny, alkiny – są związkami chemicznymi, które należą do grupy węglowodorowej.
W tym artykule przyjrzymy się alkinów.
Co to jest?
Substancje te nazywane są również acetylen węglowodorów. Struktura alkinu zapewnia obecność w cząsteczce atomy wodoru i węgla. Ogólnie wzór acetylenowe węglowodory, takie: C nH 2n-2. Najprostszym alkin prosta – acetylen (acetylen). Ma tu wzór chemiczny – C 2H 2. odnosi się również do alkinów propyn o wzorze C 3 N 4. Ponadto, dla węglowodorów acetylenowych może zawierać butyn (C4 H6) Pentin (C 5 H 8) heksynu (C 6H 10) heptyn (C 7 H 12) oktyn (C 8H 14), (nonyne C 9H 16) decyno (C 10H 18), i tak dalej. d. Wszystkie rodzaje alkinów wykazują podobne właściwości. Przeanalizujmy je szczegółowo. 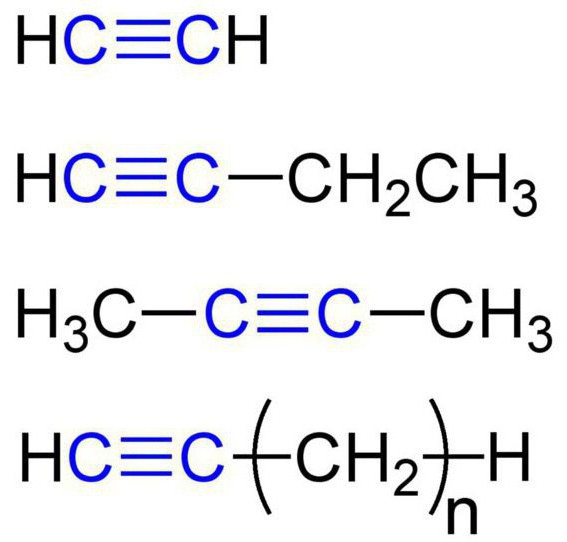
Właściwości fizyczne alkinów
Fizyczne właściwości węglowodorów acetylenowych przypomnieć alkenów.
W normalnych warunkach, alkinów, których cząsteczki zawierają od dwóch do czterech atomów węgla, mają gazowy stan skupienia. Te cząsteczki, która jest od pięciu do 16 atomów węgla, w normalnych warunkach cieczy. Te, w cząsteczkach których 17 lub więcej atomów pierwiastka chemicznego, – substancje stałe.
Alkiny stopienia i gotować w temperaturze wyższej niż alkanów i alkenów.
Rozpuszczalność w wodzie jest nieznaczna, ale nieco wyższy niż alkeny i alkany.
Rozpuszczalność w rozpuszczalnikach organicznych jest wysoka.
Najpowszechniej używane alkin – acetylen – ma takie właściwości fizyczne:
- To nie ma żadnego koloru;
- bezwonny;
- W normalnych warunkach, to jest w gazowym stanie skupienia;
- Ma mniejszą gęstość niż powietrze;
- temperatura wrzenia – minus 83,6 stopni Celsjusza;
Właściwości chemiczne alkinów
W tych substancji, przy czym atomy są połączone potrójne wiązanie, co wyjaśnia ich podstawowe właściwości. Alkiny reakcji tego typu:
- uwodornienie;
- gidrogalogenirovanie;
- fluorowcowanie;
- nawodnienie;
- spalanie.
Weźmy je w kolejności. 
uwodornienie
Właściwości chemiczne alkinów umożliwić im do prowadzenia reakcji tego typu. Ten rodzaj oddziaływania chemicznego, znamienny tym, że cząsteczka wiąże się do substancji dodatkowych atomów wodoru. Oto przykład takiej reakcji chemicznej w przypadku propyn:
2H 2 + C 3 H 4 = C 3H 8
Reakcja ta zachodzi w dwóch etapach. W pierwszej cząsteczki propyn dołącza dwa atomy wodoru, a drugi – w tej samej ilości.
chlorowcowania
Jest to kolejny reakcyjną, która znajduje się z właściwości chemicznych alkinów. Jego wynik cząsteczki węglowodoru acetylenowego przywiązuje atomów halogenu. Te ostatnie obejmują elementy, takie jak atom chloru, atom bromu, atom jodu, etc.
Oto przykład takiej reakcji w przypadku etynyl:
C2-H2 + 2SІ 2 = C 2H 2 s² 4
Ten sam proces jest również z innych węglowodorów acetylenowych.
Gidrogalogenirovanie
Jest to także jeden z głównych reakcji, która jest częścią właściwości chemicznych alkinów. To polega na tym, że substancję poddaje się reakcji ze związkami takimi jak NSІ, Ni, HBr, i innych. Ta reakcja chemiczna zachodzi w dwóch etapach. Spójrzmy na reakcję tego typu na przykład metabolitów:
C2-H2 + NSІ = C 2H 3 s²
C2-H2 + s² NSІ = C 2H 4 s² 2 
uwodnienie
Jest to reakcja chemiczna, która jest w kontakcie z wodą. Występuje także w dwóch etapach. Spójrzmy na to na przykładzie metabolitów:
H 2O + C 2H 2 = C 2H CH3OH
Substancja, która tworzy się po pierwszym etapie reakcji, zwany alkohol winylowy.
Ze względu na fakt, że zgodnie z zasadą Eltekova OH grupą funkcyjną nie mogą przylegać do podwójnego wiązania, przegrupowanie węgla, w wyniku której tworzy się alkohol winylowy aldehydu octowego.
Proces reakcji uwodnienia zwany także alkin Kucherova. 
palenie
Ten proces oddziaływanie alkinów w tlen w wysokiej temperaturze. Rozważmy spalania substancji z tej grupy z acetylenem na przykład:
2C 2H 2O 2 + 2 = 2 H 2O + CO 2 + 3C
Gdy nadmiar tlenu, acetylen i inne alkiny palić się bez tworzenia się dwutlenku węgla. Zatem przydzielane tylko tlenek węgla i wodę. Tutaj jest równaniem reakcji z, na przykład propyn:
4O 2 + C 3 H 4 = 2H 2O + 3SO 2
Spalanie innych węglowodorów acetylenowych występuje również w podobny sposób. W rezultacie, woda jest uwalniana i dwutlenek węgla.
inne reakcje
Acetyleny są również zdolne do reakcji z solami metali, takich jak srebro, miedź i wapń. Tak więc nie jest podstawienie atomów wodoru metalu. Rozważmy następujący przykład z uwagi na reakcję z acetylenem i azotanu srebra:
C2-H2 + 2AgNO3 = Ag 2C 2NH 2 + 3 + 4 NO 2H 2O
Innym interesującym proces obejmujący alkiny – Zelinsky reakcji. To tworzenie benzenu z acetylenu przy ogrzaniu do 600 stopni Celsjusza, w obecności węgla aktywnego. Równanie dla tej reakcji można przedstawić w następujący sposób:
3C 2 H2 = C 6H 6
Polimeryzacja alkinów, jak to możliwe – proces połączenie kilku cząsteczek substancji polimeru. 
odbiór
Acetylen reakcji, które opisano powyżej, wytwarza się w warunkach laboratoryjnych na kilka sposobów.
Pierwszy – dehydrohalogenowanie. Równanie reakcji wygląda w następujący sposób:
C 2 H 4 Br2 + 2KOH = C 2H 2 + 2H 2O + 2KBr
Dla przeprowadzenia tego procesu jest ogrzewanie reagentów i dodać etanol jako katalizatora.
Ponadto istnieje możliwość alkinów ze związków nieorganicznych. Oto przykład:
Cac 2 + H 2O = C 2H 2 2CA + (OH) 2
Kolejny sposób wytwarzania alkin – odwodornienia. Oto przykład takiej reakcji:
= 3 H 2 CH 2 C 4 + 2 H2
Z tego typu reakcji można uzyskać nie tylko acetylen, ale inne węglowodory acetylenowe.

Zastosowanie alkinu
Najbardziej powszechnie stosowane w przemyśle była najprostsza alkin – acetylen. Jest on powszechnie stosowany w przemyśle chemicznym.
- Potrzebne acetylen lub inne alkinów do produkcji jednej inne związki organiczne , takie jak ketony, aldehydy, i innych rozpuszczalników.
- Również z alkinów można otrzymać substancje, które są stosowane do wytwarzania kauczuków, polichlorek winylu i inne.
- Z propyn można otrzymać jako wynik RAKTs Kucherova acetonu.
- Ponadto, acetylen stosuje się do wytwarzania środków chemicznych, takich jak kwas octowy, węglowodory aromatyczne, alkoholu etylowym.
- Więcej acetylen jest stosowany jako paliwo o bardzo wysokiej temperatury spalania.
- Ponadto etynylo reakcja spalania jest używany do spawania metali.
- Ponadto, przy użyciu acetylenu można wytwarzać węgla technicznej.
- Ponadto, substancja ta jest wykorzystywana w autonomicznych urządzeń.
- Acetylen i inne węglowodory, ilość tej grupy są używane jako propelentów ze względu na wysoką temperaturę spalania.
W tej aplikacji alkinów kończy. 
wniosek
Jako końcowej części tabela przedstawia zestawienie właściwości węglowodorów acetylenowych i ich wytwarzania.
| Imię reakcje | wyjaśnienia | Przykład równanie |
| chlorowcowania | Reakcję addycji cząsteczkę węglowodoru acetylenowego atomów fluorowca (atom bromu, jodu, chloru, itd.). | C4 H6 2I + 2 = C 4H 6 I 2 |
| uwodornienie | Reakcję addycji alkinu cząsteczce atomy wodoru. Występuje w dwóch etapach. |
C3 H4 + H2 = C 3H 6 C 3H 6 + H2 = C 3H 8 |
| Gidrogalogenirovanie | Reakcję addycji acetylenowej cząsteczki węglowodoru gidrogalogenov (Ni NSІ, HBr). Występuje w dwóch etapach. |
C2-H2 + Ni = C 2 I H 3 C2-H 3 + Ni I = C 2H 4 I2 |
| uwodnienie | Reakcje, które jest oparte na interakcji z wodą. Występuje w dwóch etapach. |
C 2H 2 + H 2O = C 2H CH3OH C2H CH3OH = CH3 CHO |
| Pełna utleniania (spalania) | Atsetilenovgo reakcji węglowodoru z tlenem w podwyższonej temperaturze. Daje to tlenek węgla i wodę. |
2C 2H 5 + 5O 2 = 2H 2O + 4CO 2 2C 2H 2O 2 + 2 = H 2O + CO 2 + 3C |
| Reakcje z solami metali | Polega on na tym, że atomy metalu są podstawione atomami w cząsteczkach wodoru węglowodorów acetylenowych. |
C2-H2 + AgNO3 = C2 Ag + 2NH 2 3 4 NO + 2H 2O |
Uzyskaj alkiny może być w laboratorium przy użyciu trzech metod:
- związki nieorganiczne;
- odwodornienia związków organicznych;
- Sposób dehydrohalogenowanie substancji organicznych.
Więc spojrzał na wszystkich właściwości fizycznych i chemicznych alkinu, sposoby ich wytwarzania, zastosowania w przemyśle.