Jedną z przeszkód w pierwszych krokach studiowania prawa chemiczne i fundamentów jest napisać reakcje chemiczne. W związku z tym, nie znaleziono pytania dotyczące interakcji CaCl2, H2SO4 okresowo systematycznie. Zbadajmy główne „problem” chwile.
Rekord równanie cząsteczkowej
Interakcja między chlorek wapnia (sól) i kwasem siarkowym przepływa przez mechanizm wymiany.
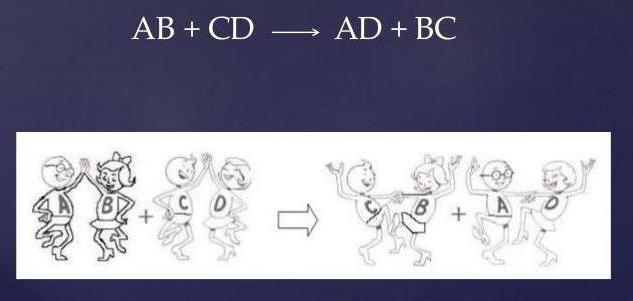 Cechy tej reakcji są:
Cechy tej reakcji są:
- dwa przyłącza na wlocie (surowce);
- dwa przyłącza na wyjściu (produkt);
- zupełny brak prostych substancji.
Wymianie ze sobą reaktywne grupy, reagenty są modyfikowane i równanie przyjmuje postać:
CaCl2 + H2SO4 + = CaSO4 2HCI.
Jak można zauważyć, dwie złożone substancje zmieniające się jony tworzą bardzo różnych związków: nowa sól (CaSO4) i kwas chlorowodorowy (HCI).
Płynąć do końca
Odpowiedzi na to pytanie jest po prostu pisząc CaCl2 równaniem H2SO4 w formie cząsteczkowej. Rodzaju produktów i wszystko zależy. Do końca tego procesu jest w przypadku edukacji:
- substancji rozpuszczalnych (szlamu);
- lotny związek (gaz);
- malodissotsiiruschego odczynnik (woda, słabe elektrolitu).
W zamian za to przypadku CaCl2 H2SO4 spośród produktów reakcji siarczanu wapnia – związek słabo rozpuszczalna wytrąca się zgodnie z tabelą.
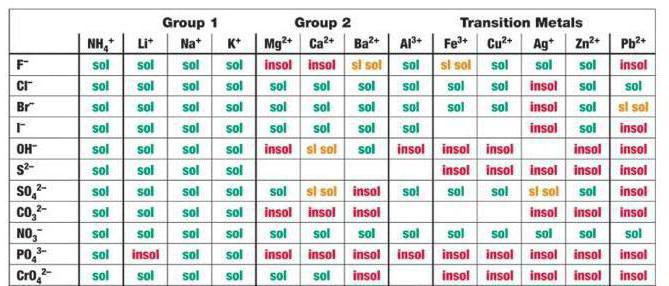
W związku z tym, proces wymiany odbędzie się do końca.
Podsumowując postaci jonowej między CaCl2 zapisu, H2SO4
Wypisywanie wszystkie związki rozpuszczalne w jony i zmniejszenia cyklicznych grup reaktywnych, otrzymujemy dwa równania przed nieznanym:
- kompletny zapis postaci jonowej między CaCl2, H2SO4
Ca2 + 2cl – + 2H + + więc 4 2 = CaSO4 + 2H + 2cl –
- skróconą postacią wzoru
Ca2 + SO 4 2 = CaSO4.
Należy pamiętać, że tylko jony malowane rozpuszczalne sole, kwasy, zasady (to łatwo określić na podstawie specjalnych tabelach). Słaby elektrolity typu węglowy lub kwas octowy zawsze zapisywane w postaci molekularnej.
Teraz wiesz, jak interakcja między chlorek wapnia (sól) i kwasu siarkowego.











