Krzemu i jego związki. Krzemu w przyrodzie. Użycie silikonu
Jednym z najbardziej popularnych w sztuce i przemyśle elementów jest krzem. Że zawdzięcza swoje niezwykłe właściwości. Obecnie istnieje wiele różnych związków tego pierwiastka, które odgrywają ważną rolę w syntezie i tworzeniu produktów technicznych, szkła, szkła, urządzeń, materiałów budowlanych, biżuterii i innych gałęziach przemysłu.

Ogólna charakterystyka krzem
Jeśli weźmiemy pod uwagę pozycję krzemu w układzie okresowym, możliwe jest, aby powiedzieć:
- IV znajduje się w głównych podgrup grupy.
- Sekwencja numer 14.
- masa atomowa 28,086.
- Symbol chemiczny Si.
- Nazwa – krzem, lub po łacinie – krzemu.
- Konfiguracji elektronowej warstwy zewnętrznej 4E: 2e 8e.
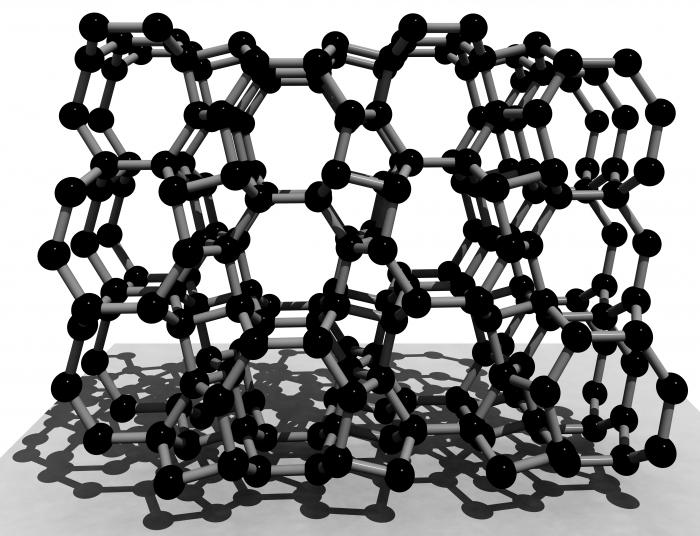
Sieć krystaliczna krzemu jest podobna do siatki diamentowej. Węzły są umieszczone węgla, jego typ – sześcienny płaskocentryczną. Jednakże, ze względu na większą długość komunikacji właściwości fizycznych krzemu silnie różnią się od właściwości modyfikacji alotropowych węgla.
Właściwości fizyczne i chemiczne
Istnieją dwa alotropowa modyfikacja elementu: amorficzne i kryształu. Są one bardzo podobne. Jednakże, jak w przypadku innych materiałów, główna różnica między nimi – w sieci krystalicznej krzemu.
W tym przypadku, obie wersje – proszek różnych kolorach.
1. Krystaliczny krzemu błyszczące ciemno szary proszek, takich jak metal. Jego struktura odpowiada diamentu, ale różnych właściwościach. Posiada:
- kruchość;
- niską twardość;
- właściwości półprzewodnikowe
- Temperatura topnienia 1415 0 C;
- gęstość 2,33 g / cm3;
- Temperatura wrzenia 2700 0 ° C
Jego aktywność chemiczna jest niskie w porównaniu do innych postaci alotropowych.
2. amorficznego krzemu – brązowy proszek ma strukturę diamentu silnorazuporyadochennogo. Reaktywność jest wystarczająco wysoka.
Ogólnie rzecz biorąc, należy zaznaczyć, że reakcję negatywnych krzemu. Aby dojść do reakcji, niezbędne temperatury nie niższej niż 0 ° C 400-500 Różne związki chemiczne są utworzone z krzemem w tych warunkach. Takich jak:
- tlenków;
- halogenki;
- samobójstwa;
- azotków;
- borki;
- węglików.
Może oddziaływanie krzemu z kwasem azotowym lub alkalicznego, które nazywa się procesem trawienia. Powszechne silikony, które są obecnie coraz bardziej powszechne.
Będąc w przyrodzie
Krzem występuje naturalnie w dość znacznej ilości. To drugie miejsce po występowania tlenu. Ich udział wagowy wynosi około 30%. Wody morskiej zawiera składnik aktywny w stężeniu 3 mg / l Dlatego nie możemy powiedzieć, że krzem w przyrodzie – jest rzadkim elementem.
Wręcz przeciwnie, istnieje wiele różnych skał i minerałów, w ramach którego występuje i od którego można je pobrać. Najczęstszymi naturalnych związków krzemu są:
- Krzemionka. Wzór chemiczny SiO2. Jest dość różnorodne formy minerałów i skał na jej skład: piasek, krzemień, skaleń, kwarc, kryształ górski, ametyst, chalcedon, opal, karneol, jaspis i innych.
- Krzemiany i glinokrzemiany. Kaolin, skaleń, mika, sole, kwas krzemowy, azbest, talk.
Tak więc, szeroko rozpowszechniona w przyrodzie krzemu i jego związki są popularne i zapotrzebowanie na ludzi do wykorzystania do celów technicznych.

Krzemu i jego związki
Ponieważ czysta uważane istnieje element, nie może zatem mieć różne znaczenie jego związków. Z chemicznego punktu widzenia, mogą być trzy stopnie utlenienia +2, +4, -4. Wychodząc z tego, a także ze względu na swą bezwładność, a zwłaszcza w strukturze krystalicznej, wytwarza się następujące główne rodzaje substancji:
- Związki binarne z niemetali (silan, węglik, azotek, fosforku, i tak dalej;
- tlenków;
- kwas krzemowy;
- krzemiany metali.
Weźmy pod uwagę, jak ważne krzem i jego związki, są najbardziej powszechne i popularne dla ludzi.

tlenki krzemu
Istnieją dwa typy substancji wyrażone wzorem:
- SiO;
- SiO 2.
Jednak najczęściej stosowany jest dwutlenek węgla. występuje w naturze w postaci bardzo pięknych kamieni półszlachetnych:
- agat;
- chalcedon;
- opal;
- karneol;
- Jasper;
- ametyst;
- Rhinestone.
Zastosowanie krzemu w tej formie znalazła swoje zastosowanie w produkcji biżuterii. Niewiarygodnie piękne złota i srebrna biżuteria wykonana z tych półszlachetne i kamieni półszlachetnych.
Kilka odmian krzemionki:
- kwarcowy;
- rzeki i piasku kwarcowego ;
- krzemień;
- skalenie.
Zastosowanie krzemu w takich typach realizowanych w budownictwie, inżynierii, elektroniki, przemysł chemiczny, hutnictwo. Razem, wymienione tlenki odnosi się do pojedynczej substancji, – krzemionkę.
Karbid Kremniya i jego wykorzystanie
Krzemu i jego związki – materiał w przyszłości, obecnie. Jednym takim materiałem jest węglik krzemu lub węglik elementu. Wzór chemiczny SiC. Występuje w naturze jako Moissanite mineralnej.
W czystej postaci węgla i związku krzemu – piękny, przeźroczystych kryształów struktury podobnej do diamentu. Jednak dla celów technicznych stosowanych malowane w kolorze zielonym i czarnym kolorze materiału.
Główne cechy substancji, co pozwala na jego stosowanie w przemyśle, technologii, przemysłu chemicznego, co następuje:
- szeroka szczelina półprzewodników;
- bardzo dużej wytrzymałości (7 skali Mohsa) ;
- odporne na działanie wysokiej temperatury;
- doskonała elektroustoychivost i przewodności cieplnej.
Wszystko to pozwala na użycie węglika krzemu jako materiału ściernego w syntezie chemicznej i metalurgii. Diody Ponadto, jest oparte wytwarzają szerokie spektrum działania, części do pieca szklarskiego, dysze, palniki, biżuteria (Moissanite docenione FIANITE powyżej).

Silan i jego znaczenie
Związek wodoru krzemu silanu i nazwa nie może być uzyskana przez bezpośrednią syntezę z materiałów wyjściowych. W celu otrzymania różnych krzemki metali są stosowane, które są poddane obróbce kwasem. W rezultacie, silan uwolnienia gazu i tworzy się sól metalu.
Interesujące jest to, że związek w pytaniu nie wyprodukował sam. Zawsze w reakcji z mieszaniną mono-, di- i Trisilane w których atomy krzemu są połączone ze sobą w sieci.
Na właściwości tych związków – silne ograniczenie. Sobie tak łatwo utleniane przez tlen, czasami wybuchowo. Gwałtowna reakcja z halogenami zawsze z dużą ilością uwalniania energii.
Stosowanie następujących silanów:
- Reakcje syntezy organicznej, w wyniku której jest ważne, aby – silikonów, kauczuków silikonowych, środków uszczelniających, smarów, emulsji i innych.
- Microelectronics (monitory LCD, zintegrowanych schematy techniczne, etc.).
- Wysoka polisilikonowy czystość.
- protetyka dentystycznego.
Zatem silanów we współczesnym świecie jest wysoka.

kwas krzemowy i krzemiany
Wodorotlenek elementu – są różne krzemionki. wyróżnia się:
- meta;
- O;
- polisilikonowy i inne kwasy.
Wszystkie z nich mają wspólne cechy – skrajną nierównowagę w stanie wolnym. Są one łatwo rozkładowi pod wpływem ciepła. W normalnych warunkach, są krótkotrwałe, przekształcając najpierw do zolu, a następnie żel. Po wysuszeniu, żele krzemionkowe, takie struktury są zwane. Służą one jako adsorbentów w filtrach.
Ważna z punktu widzenia przemysłu, są sole kwasów krzemowych – krzemiany. Są one podstawą sporządzenia takich substancji, takich jak:
- szkło;
- beton;
- cement;
- zeolit;
- kaolin;
- porcelany;
- ceramika;
- kryształów;
- ceramika.
Krzemiany metali alkalicznych, – rozpuszczalne w wodzie, a reszta – nie. W związku z tym, krzemian sodu i potasu jest nazywany szkłem wodnym. Normalna kleju piśmienne – jest to sól sodowa kwasu krzemowego.
Ale najbardziej interesujące związki są tego samego szkła. Których tylko opcje dla tej substancji nie ma pojęcia! Dziś, zważywszy kolorowe, optyczne, opcje mat. Wyroby szklane jest zaskakujące w swej okazałości i różnorodności. Podczas dodawania pewnych tlenków metali i niemetali, do mieszaniny można uzyskać różne typy szkła. Czasami, nawet w tej samej kompozycji, ale różne zawartości procentowe składników prowadzi do różnic we właściwościach substancji. Przykładami są porcelanowe i ceramiczne, o wzorze * SiO 2 AI 2O 3 * K 2O
Szkło kwarcowe – to postać o wysokiej czystości, której kompozycja jest opisana jako krzemionki.

oparty na odkryciu związków krzemu
W ciągu ostatnich kilku lat, badania wykazały, że krzem i jego związki – najważniejsze uczestników w normalnym stanie organizmów żywych. Niedobór C lub nadmiar danego elementu połączonego chorób, takich jak:
- rak;
- gruźlica;
- zapalenie stawów;
- zaćma;
- trąd;
- czerwonka;
- reumatyzm;
- zapalenie wątroby i inne.
procesy starzenia się również związane z ilościowej zawartości krzemu. Liczne badania na ssaków wykazały, że brak wirusa element posiadający ataków serca, udarów, rak i zapalenie wątroby typu C jest włączony.