W każdej żywej komórce występuje wiele reakcji chemicznych. Enzymy (enzymy) są białkami o specjalnych i niezwykle ważnych funkcjach. Nazywają się biokatalizatorami. Główną funkcją enzymów białkowych w organizmie jest przyspieszenie reakcji biochemicznych. Początkowy odczynnik, którego oddziaływanie jest katalizowane przez te cząsteczki zwane są substratami, a końcowymi związkami są produkty.
W naturze białka enzymów działają tylko w żywych systemach. Ale w nowoczesnej biotechnologii, diagnostyce klinicznej, farmaceutykach i medycynie, oczyszczonych enzymach lub ich kompleksach, a także dodatkowych komponentach niezbędnych do działania systemu i wizualizacji danych dla badacza.
Biologiczne znaczenie i właściwości enzymów
Bez tych cząsteczek żyjący organizm nie mógłby funkcjonować. Wszystkie procesy aktywności życiowej współpracują ze sobą dzięki enzymom. Główną funkcją białek-enzymów w organizmie jest regulacja metabolizmu. Bez nich normalny metabolizm jest niemożliwy. Regulacja aktywności molekuł występuje w działaniu aktywatorów (induktorów) lub inhibitorów. Kontrola działa na różnych poziomach syntezy białek. On też "działa" dla już gotowej cząsteczki.
Głównymi właściwościami enzymów białkowych są specyficzność wobec pewnego podłoża. I, odpowiednio, zdolność do katalizowania tylko jednego lub, rzadko, serii reakcji. Zazwyczaj takie procesy są odwracalne. Oba funkcje są odpowiedzialne za oba enzymy. Ale to nie wszystko.
Rola białek-enzymów jest niezbędna. Bez nich nie zachodzą reakcje biochemiczne. Dzięki działaniu enzymów staje się możliwe, aby odczynniki pokonały barierę aktywującą bez znacznego zużycia energii. W ciele nie jest możliwe podgrzanie temperatury powyżej 100 ° C lub użycie agresywnych składników, takich jak laboratorium chemiczne. Enzym białkowy łączy się z podłożem. W stanie związanym następuje modyfikacja, po której następuje uwolnienie tego ostatniego. W ten sposób wszystkie katalizatory stosowane w syntezie chemicznej działają.
Jakie są poziomy organizacji cząsteczki białka-enzymu?
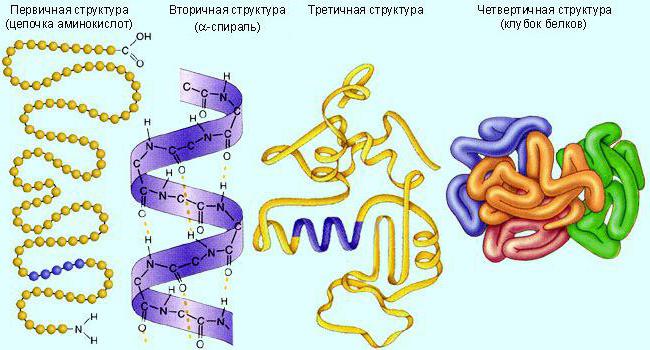
Zwykle te cząsteczki mają strukturę białkową trzeciorzędową (globulkę) lub czwartorzędową (kilka połączonych globulin). Najpierw są one syntetyzowane w postaci liniowej. A następnie załóż do wymaganej struktury. Aby zapewnić aktywność, biokatalizator potrzebuje pewnej struktury.
Enzymy, podobnie jak inne białka, są niszczone przez ogrzewanie, ekstremalne pH, agresywne związki chemiczne.
Dodatkowe właściwości enzymów
Wśród nich wyróżniono następujące cechy elementów:
- Stereospecyficzność – powstanie tylko jednego produktu.
- Regioselektywność to zerwanie wiązania chemicznego lub modyfikacja grupy w jednej pozycji.
- Chemoselektywność jest katalizacją tylko jednej reakcji.
Cechy pracy
Poziom swoistości enzymów jest zróżnicowany. Ale każdy enzym jest zawsze aktywny w odniesieniu do określonego podłoża lub grupy związków, podobnej do struktury. Katalizatory niebiałkowe nie mają tej właściwości. Specyficzność mierzy się przez stałą wiązania (mol / l), która może osiągnąć 10-10 moli / l. Działanie aktywnego enzymu jest gwałtowne. Jedna cząsteczka katalizuje tysiące milionów operacji na sekundę. Stopień przyspieszenia reakcji biochemicznych jest znaczny (1000-100000 razy) wyższy niż w konwencjonalnych katalizatorach.
Działanie enzymów opiera się na kilku mechanizmach. Najprostsza interakcja występuje z jedną cząsteczką podłoża, a następnie z formowaniem produktu. Większość enzymów może wiązać 2-3 różne cząsteczki, które wchodzą w reakcję. Na przykład transfer grupy lub atomu z jednego połączenia do innego lub podwójne podstawienie na zasadzie "pingpong". W tych reakcjach zwykle dochodzi się do jednego substratu, a drugi jest związany przez grupę funkcyjną z enzymem.
Mechanizm działania enzymu jest badany przy użyciu następujących metod:
- Definicje produktów pośrednich i końcowych.
- Badania geometrii struktury i grup funkcyjnych związanych z podłożem i zapewniające wysoką szybkość reakcji.
- Mutacje genów enzymów i określanie ich syntezy i aktywności.
Aktywne i wiążące centrum
Cząsteczka substratu jest o wiele mniejsza niż enzym białkowy. W związku z tym wiązanie występuje z powodu niewielkiej liczby grup funkcyjnych biokatalizatora. Stanowią aktywne centrum składające się z określonego zestawu aminokwasów. W złożonych białkach w strukturze występuje grupa protetyczna o charakterze niebiałkowym, która może być również częścią aktywnego ośrodka.
Konieczne jest wydzielenie oddzielnej grupy enzymów. Mają koenzym w cząsteczce, która ciągle wiąże się z cząsteczką i uwalnia się z niej. W pełni uformowany enzym białkowy nazywa się holoenzymem, a gdy kofaktor jest usuwany, nazywany jest apoenzymem. Często stosuje się witaminy, metale, pochodne zasad azotowych (NAD – dinukleotyd nikotynamid adenozyny, dinukleotyd FAD – flawinadydyna, FMN – flawin-nukleotyd) jako koenzymy.
Środek wiążący zapewnia swoistość powinowactwa do podłoża. Z tego powodu powstaje stabilny kompleks substratu enzymatycznego. Struktura globu jest skonstruowana w taki sposób, aby na powierzchni była niszowa (szczelina lub wnęka) o pewnym rozmiarze, co zapewnia wiązanie podłoża. Ta strefa znajduje się zazwyczaj w niewielkiej odległości od centrum aktywnego. Poszczególne enzymy mają miejsca sprzęgania z kofaktorami lub jonami metali.
Wnioski
Enzym białkowy odgrywa ważną rolę w organizmie. Takie substancje katalizują reakcje chemiczne, są odpowiedzialne za proces metaboliczny – metabolizm. W każdej żywej komórce ciągle występują setki procesów biochemicznych, w tym reakcje redukcyjne, rozszczepienie i synteza związków. Stale się pojawia się utlenianie substancji o dużym uwalnianiu energii. To z kolei jest wydawane na tworzenie węglowodanów, białek, tłuszczów i ich kompleksów. Produkty rozkładu są elementami strukturalnymi do syntezy niezbędnych związków organicznych.