Związki azotu. Właściwości azotu
Urodzeniu azotanu – jako przekład z łacińskiego słowa Nitrogenium. Ten tytułowy azot – pierwiastek o liczbie atomowej 7, głowica 15 grupy TH dłuższej wersji układu okresowego. W postaci prostej substancji składającej się z ziemi, rozmieszczone poduszkę – atmosfera. Różnorodność związków azotowych występujących w skorupie ziemskiej, a organizmy żywe są szeroko stosowane w przemyśle, rolnictwie, wojsku i medycynie.
Dlaczego azot o nazwie „dusi” i „martwe”
Jako historycy chemii Proponuję najpierw dostał tę prostą substancję Henry Cavendish (1777). Naukowe Powietrze przechodzi przez gorące węgle pochłaniania produktów reakcji przy użyciu alkaliów. W wyniku doświadczeń badacza znaleźć bezbarwny i bezwonny gaz, nieprzereagowany węgiel. Cavendish nazwał go „duszące powietrze” na niemożność utrzymania oddychanie i spalanie.
Nowoczesne chemiczne wyjaśnić, że tlen, poddaje się reakcji z węgla, dwutlenek węgla powstaje. Pozostałe „dusznawy” powietrza była w przeważającej części cząsteczek N2. Cavendish i inni badacze w czasie na ten temat nie jest jeszcze znana, chociaż związki azotu i azotanowe, a następnie były szeroko stosowane w gospodarce. Naukowiec powiedział o niezwykłej gazu do kolegi przeprowadzić podobne eksperymenty – Joseph Priestley.
Jednocześnie Carl Scheele zwrócił uwagę na nieznanym składnikiem powietrza, ale nie udało się prawidłowo wyjaśnić jej pochodzenie. Tylko Daniel Rutherford w 1772 roku zrozumiał, że obecne eksperymenty „dusi” „zepsute” gaz – azot. Niektórzy naukowcy uważają jego odkrywcy – to nadal jest debata historyków nauki.

15 lat po doświadczeniach Rutherforda znanym chemik Antuan Lavuaze zaproponowano zastąpienie powietrza określenie „zepsute” odnosi się do atomu azotu, z drugiej – Nitrogenium. W tym czasie wykazano, że substancja ta nie palić, nie obsługuje oddech. Potem były rosyjska nazwa „azot”, który jest interpretowany na różne sposoby. Często mówimy, że termin oznacza „bez życia”. Kolejne badania obaliły powszechne przekonanie o właściwościach substancji. Związki azotu – białka – główne makrocząsteczek w kompozycji organizmów żywych. W celu skonstruowania rośliny absorbują od żywienia mineralnego gleby niezbędnych elementów – 2- jony nr 3 i NH 4 +.
Azot – element chemiczny
Aby zrozumieć strukturę i właściwości atomowej pomaga układu okresowego (PS). Położenie elementu chemicznego układu okresowego może określić ładunek jądra, liczbę protonów, neutronów i (liczba masowa). Konieczne jest, aby zwrócić uwagę na wartość masy atomowej – jest to jedna z głównych cech elementu. Okres, liczba odpowiada liczbie poziomów energetycznych. Krótka wersja układu okresowego numer tabeli grupy odpowiada liczbie elektronów w zewnętrznym poziomie energaticheskom. Podsumowującą dane ogólne właściwości azotu przez jego położenie w układzie okresowym:
- Jest to element niemetalicznych znajduje się w prawym górnym rogu SS.
- symbol chemiczny: N.
- Numer oferty: 7.
- Względna masa atomowa: 14,0067.
- Formuła lotne związki wodoru: NH3 (amoniak).
- Formy tlenku wyższego 2O 5, która jest równa wartościowości V. azotu
Struktura atom azotu:
- ładunek jądrowy +7.
- Liczba protonów: 7; liczba neutronów: 7.
- Liczba poziomów energetycznych: 2.
- Całkowita ilość elektronów: 7; wzorze E: 1s 2 2s 2 2p 3.
Szczegóły badanych izotopów № elementem 7, a ich masa numerów – 14 i 15. Zawartość lekkich atomów, z których jest 99,64%. Jądra krótkotrwały izotopu promieniotwórczego jest 7 protonów, a liczba neutronów jest bardzo zróżnicowana: 4, 5, 6, 9, 10.
Azotu w przyrodzie
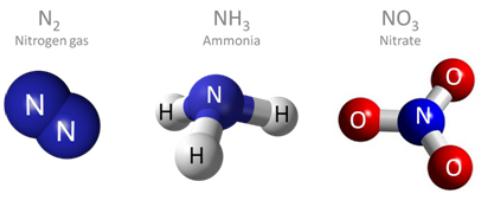
Jako części cząsteczek powietrza są obecne osłona ziemi substancję prostą, której wzór – N2. Zawartość azotu w powietrzu jest około 78,1% objętościowo. Nieorganiczne związki pierwiastków chemicznych w skorupie ziemskiej – różne sole amonowe i azotany (saletra). Związki o wzorze I, jak również nazwy niektórych z najważniejszych substancji:
- NH3 amoniak.
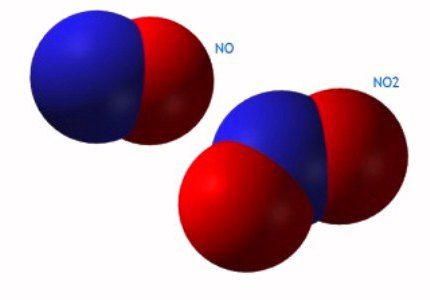
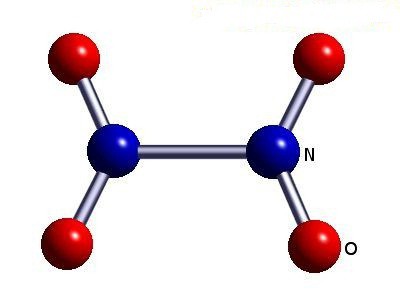
- NR 2 Dwutlenek azotu.
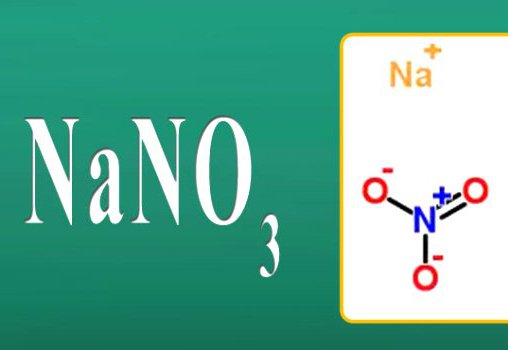
- NaNO 3 azotan sodu.
- (NH 4) 2SO 4, siarczan amonu.
Wartościowość atomu azotu w tych dwóch związków – IV. organizmów węgla, gleba, życia również zawierać atomy azotu w postaci związanej. Azot jest składnikiem aminokwasy makrocząsteczek, DNA i RNA, nukleotydów, hormonów i hemoglobiny. Całkowita zawartość pierwiastka w organizmie człowieka sięga 2,5%.
substancja prosta
Azot w postaci cząsteczek dwuatomowej – największą wielkość i ciężar w powietrzu atmosferycznym. Substancja, której wzór jest N2 ma zapach, barwę i smak. Gaz ten jest więcej niż 2/3 ziemia powietrze pochwa. Ciekły azot jest w postaci bezbarwnej substancji, przypominający wody. Wrze w temperaturze -195,8 ° C M (N2) = 28 g / mol. nieco substancji prosty łatwiej tlen, azot, powietrze, jego gęstość jest bliska 1.
Atomy w cząsteczce silnie wiążą 3 dodanych par elektron. Związek charakteryzuje się wysoką odpornością chemiczną, która odróżnia ją od tlenu i innych substancji gazowych. Cząsteczkę azotu dzieli się na jego atomów składowych niezbędnych do wydatkowania energii 942.9 kJ / mol. Styku z trzech par elektronów, jest bardzo mocne, zaczyna się rozkładać przy ogrzewaniu powyżej 2000 ° C,
praktycznie nie występuje w normalnych warunkach dysocjację cząsteczek na atomy. obojętność chemiczna jest również spowodowane przez azot całkowity brak polaryzacji w cząsteczce. oddziałują one bardzo słabo ze sobą, a tym samym działa gazowy stan skupienia materii, przy normalnym ciśnieniu i w temperaturze zbliżonej do temperatury pokojowej. Mała aktywność chemiczną cząsteczkowego azotu stosuje się w różnych procesach i urządzeniach, w których jest to niezbędne, aby utworzyć środowisku obojętnym.
Dysocjacja cząsteczek N2 mogą wystąpić pod wpływem promieniowania słonecznego w górnej warstwie atmosfery. azotu atomowego jest utworzony, który reaguje z niektórymi metali i niemetali w normalnych warunkach (fosforu, siarki, arsenu). Wynikiem jest synteza substancji będących warunków gruntowych uzyskanych w sposób pośredni.

wartościowość azotu
Zewnętrzna powłoka elektronowa atomu tworzą 2 a 3, a p elektron. Te negatywne azotu może dawać cząstki podczas interakcji z innymi elementami, które odpowiadają jej właściwości redukujących. Obok brakującą oktet do 3 atomach elektronowej wykazuje zdolności utleniającej. azotu, elektroujemność poniżej jego właściwości metaliczne są mniej wyraźne niż atom fluoru, tlenu i chloru. Podczas interakcji z tych pierwiastków azotu daje elektronów (utlenienia). Redukcja jonów ujemnych, a następnie reakcji z innych metali i niemetali.
Typowe wartościowość azotu – III. W tym przypadku, wiązania chemiczne są utworzone przez zewnętrzną p-przyciągania elektronów i utworzenie wspólnego (wiązania) pary. Azot jest zdolna do tworzenia wiązania donor-akceptor ze względu na wolną parę elektronów, jak jon amonowy NH 4+.
Pierwsze w laboratorium i przemyśle
Metody jednym laboratorium w oparciu o właściwości utleniających z tlenku miedzi. Użyciu związku azotu z wodorem – amoniak NH3. Ten nieprzyjemny zapach vzaimoddeystvuet gazu ze sproszkowanym tlenkiem miedzi czerni. Powstałą mieszaninę reakcyjną wytwarza azot i pojawia się miedź metaliczną (czerwony proszek). Osadzają się na ścianach rur waterdrops – inny produkt reakcji.
Inna metoda laboratoryjna, że stosuje się związek azotowy z metali – azydku, np NaN3. Uzyskane przez gaz, który nie musi być oczyszczone z zanieczyszczeń.
Laboratorium przeprowadza rozkład azotanu amonowego w azot i wodę. Aby rozpocząć reakcję, potrzebne jest ogrzewanie, a następnie proces przechodzi z wydzielaniem ciepła (reakcja egzotermiczna). Azot zanieczyszczony, tak że jest czyszczone i suszone.
Wytwarzanie azotu w branży:
- Destylacja frakcyjna ciekłego powietrza – w sposób, który wykorzystuje właściwości fizyczne, azotu i tlenu (różne temperatury wrzenia);
- Reakcja chemiczna powietrza z gorącym węgla;
- adsorpcyjnego rozdzielania gazów.
Oddziaływanie z metalami i wodoru – Utlenianie
Bezwładności trwałych cząsteczek nie umożliwia również bezpośrednie syntezę związków azotowych. Aby uaktywnić atomy niezbędne do silnego ogrzewania lub napromieniania substancji. Azot może reagować z litu, w temperaturze pokojowej, z magnezu, wapnia i sodu, reakcję prowadzi się wyłącznie przez ogrzewanie. powstają odpowiednie azotków metali.
Interakcja z azotu i wodoru odbywa się w wysokiej temperaturze i ciśnieniu. Również ten proces wymaga katalizatora. Amoniaku otrzymany – jednym z najważniejszych syntezy chemicznej. Azot, jako środek utleniający, wykazuje w ich tri negatywnych stanów utlenienia:
- 3 (amoniak oraz inne związki azotu, wodoru – azotki);
- -2 (hydrazyny N 2 H4);
- -1 (hydroksylaminy NH2OH).
Najważniejszą azotek – Amoniak – przygotowany w dużych ilościach w przemyśle. Dużym problemem długo pozostawał obojętność chemiczną azotu. Jej źródła surowców były azotan, ale zastrzega mineralnych zaczęła gwałtownie spadać do ze wzrostem produkcji.

Wielkim osiągnięciem nauki i praktyki chemicznego tworzenia techniki wiązania azotu amonowego w skali przemysłowej. W szczególnych kolumn jest przez bezpośrednią syntezę – procesem odwracalnym pomiędzy azotu otrzymany z powietrza i wodoru. Przy tworzeniu optymalnych warunków, przesuwa równowagę reakcji tej strony wyrobu, przy użyciu katalizatora amoniaku wydajność wynosi 97%.
Interakcji z tlenem – zmniejszenie właściwości
W celu rozpoczęcia reakcji azot i tlen muszą być silne ogrzewanie. Posiadać wystarczającą ilość energii łuku elektrycznego oraz piorunem wypuszczania do atmosfery. Najważniejsze związki nieorganiczne, w których azot jest w swoim dodatnim stopniu utlenienia:
- 1 (tlenek azotu (I) 2O);
- + 2 (NO tlenku azotu);
- 3 (tlenek azotu (III) 2O 3, HNO2 kwas azotawy, jego sole) azotyny;
- 4 (dwutlenek azotu (IV), NO 2);
- 5 (pięciotlenek azotu (V), N 2O 5, HNO3 kwas azotowy, azotany).
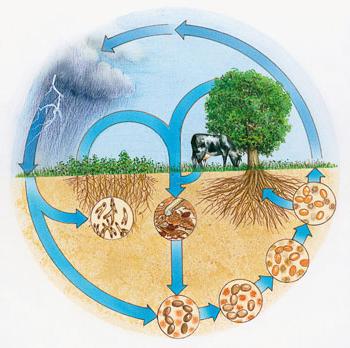
Wartość naturalnie występujących
Rośliny pobierają jony amoniowe i aniony azotanowe z podłoża użytego do syntezy reakcji chemicznych związków organicznych w komórkach stale pracuje. Atmosferyczne bakterie guzek azotu mogą przyswoić – jednostki tworzące mikroskopijne grudki na korzeniach roślin strączkowych. W rezultacie ta grupa roślin otrzymał wymaganą baterię, wzbogaca glebę.
Tropikalnych podczas burz występuje reakcja utleniania azotu atmosferycznego. Tlenki rozpuszczono z wytworzeniem kwasów, te związki azotu wprowadzić do gleby w wodzie. Ze względu na cykl pierwiastków w przyrodzie są stale uzupełniane swoje rezerwy w skorupie ziemskiej, w powietrzu. Złożone cząsteczki organiczne zawierające azot w jego skład są degradowane przez bakterie na składników nieorganicznych.
praktyczne wykorzystanie
Najważniejsze związki azotu dla rolnictwa – wysoce rozpuszczalna sól. Wchłaniane przez rośliny mocznika, azotanu (sód, potas, wapń), związki amoniowe (woda amoniaku, chlorek, siarczan, azotan amonu).
Obojętne właściwości azot rośliny niezdolności do absorbowania z zewnątrz prowadzi do konieczności wprowadzania dużych dawek rocznie azotany. Części organizmu roślinnego są w stanie przechowywać energię makrokomórce „na przyszłość”, które pogarszają jakość produktu. Nadmiar azotanów w warzywach i owocach może spowodować zatrucie u ludzi, wzrost guzów złośliwych. Ponadto w rolnictwie związki azotu stosowane w innych gałęziach przemysłu:
- do wytwarzania środków leczniczych;
- w przypadku syntezy związków o wysokim ciężarze cząsteczkowym;
- do wytwarzania materiałów wybuchowych z trotylu (TNT);
- do wytwarzania barwników.
Na tlenku znajduje zastosowanie w chirurgii, substancja ma działanie przeciwbólowe. Utrata czucia podczas wdychania gazu zauważył, że nawet pierwsi badacze atomu azotu, właściwości chemiczne. Więc nie było wspólna nazwa „gaz rozweselający”.
Problem azotanów w produktach rolnych
Sole kwasu azotowego, – azotany – zawierał pojedynczo anionu NR 3. Nadal stosować starą nazwę grupy substancji – azotanu amonu. Azotany są wykorzystywane do nawożenia pól, w szklarniach, ogrodach. Przynieś je wczesną wiosną przed sadzeniem, w lecie – w postaci płynnych karmienia. Przez siebie, substancja nie stwarza wielkie niebezpieczeństwo dla ludzi, ale w organizmie, są one przekształcone w azotyny, a następnie w nitrozoaminy. Azotyn NO 2- jonów – toksyczne cząsteczki, powodują utlenianie żelaza żelaza cząsteczek hemoglobiny jonów trójwartościowych. W tym stanie, główną substancję krwi ludzi i zwierząt nie jest w stanie do transportu tlenu i usuwania dwutlenku węgla z tkanek.
Im bardziej niebezpieczne zanieczyszczenie azotan żywności dla zdrowia człowieka:
- złośliwych guzów powstałych w trakcie konwersji azotanów nitrozoaminy (rakotwórczy);
- rozwój wrzodziejącego zapalenia jelita grubego,
- niedociśnienie lub nadciśnienie tętnicze;
- niewydolność serca;
- zaburzeń krwawienia
- Uszkodzenia wątroby, trzustki i rozwoju cukrzycy;
- rozwój niewydolności nerek;
- niedokrwistość, zaburzenia pamięci, uwagi i inteligencji.
Jednoczesne stosowanie innych produktów z dużymi dawkami azotanów prowadzi do ostrego zatrucia. Źródła mogą być rośliny, woda pitna, gotowe dania mięsne. Kąpieli w czystej wodzie i gotowanie może zmniejszyć zawartość odżywczą produktów azotanów. Naukowcy odkryli, że większe dawki związków niebezpiecznych obserwowane w produkcji i niedojrzałych roślin cieplarnianych.

Fosfor – element azotowce
Atomy pierwiastków chemicznych, które są w tej samej pionowej kolumny układu okresowego wykazują wspólne cechy. Fosforu znajdującego się w trzecim okresie, odnosi się do grupy 15, jak również azot. Elementy konstrukcji podobnej węgla, ale istnieją różnice we właściwościach. Azot i fosfor wykazuje ujemną walencyjne i utlenienia III w ich połączeń z metalami i wodoru.
W normalnych temperaturach występuje wiele reakcji fosforu, jest to chemicznie czynny element. Interakcje z tlenem tworzą wyższy tlenek P 2 O 5 . Wodny roztwór tej substancji ma właściwości kwasu (kwasu metafosforowego). Po podgrzaniu uzyskuje się kwas ortofosforowy. Tworzy kilka rodzajów soli, z których wiele służy jako nawozy mineralne, na przykład superfosforany. Związki azotu i fosforu stanowią istotną część cyklu substancji i energii na naszej planecie, są one stosowane w przemyśle, rolnictwie i innych dziedzinach działalności.