Elektrolity są substancje chemiczne znane od czasów starożytnych. Jednak większość obszary ich zastosowania, wygrali niedawno. Omówimy priorytetem dla przemysłu stosowanie tych substancji, a my rozumiemy, że przeszłość jest teraźniejszością, a różnią się od siebie. Ale zaczynamy z dygresji do historii.

historia
Najstarsza znana elektrolity – sole i kwasy jest otwarty nawet w starożytnym świecie. Jednak zrozumienie struktury i właściwości elektrolitów ewoluowały w czasie. Teoria procesy te ewoluowały od 1880 roku, kiedy powstał szereg odkryć, teorii dotyczących właściwości elektrolitu. Było wiele skoków kwantowych w teorii opisujących mechanizmy oddziaływania elektrolitów w wodzie (w tym, jedynie rozwiązanie nabywają właściwości, które sprawiają, że ich zastosowanie w przemyśle).
Teraz widzimy dokładnie kilka teorii, które miały największy wpływ na rozwój koncepcji elektrolitów i ich właściwości. Zacznijmy od najbardziej powszechnych i prostej teorii, że każdy z nas wziął w szkole.
Arrheniusa teoria dysocjacji elektrolitycznej
W 1887 roku szwedzki chemik Svante Arrheniusa i chemik rosyjsko-niemiecki Wilhelm Ostwald rozwinął teorię dysocjacji elektrolitycznej. Jednak i tu, to nie jest takie proste. Arrheniusa sam wspiera się tzw fizyczne teorii roztworów, które nie biorą pod uwagę współdziałania składników substancji w wodzie i stwierdził, że są wolne naładowanych cząstek (jony) w roztworze. Nawiasem mówiąc, z takich pozycji dzisiaj rozważamy dysocjacji elektrolitycznej szkoły.
Mówimy wszystko to samo sprawia, że teoria i jak to wyjaśnia mechanizm oddziaływania substancji z wodą. Podobnie jak w przypadku każdej innej pracy, to ma kilka postulatów, że zastosowań:
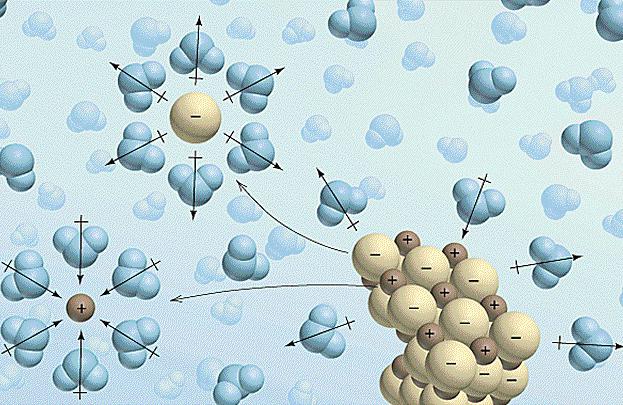
1. W wyniku reakcji wody z substancją rozpada się w jony dodatnie (- i ujemne kationów – anionowy). Cząstki te poddaje się hydratacji przyciągają cząsteczki wody, które, nawiasem mówiąc, są pobierane z jednej strony korzystnie, a z drugiej – ujemny (dipol) utworzonego w celu wytworzenia kompleksów wodnych (solwaty).
2. Sposób dysocjacji jest odwracalna – to znaczy, że substancja jest podzielona na jony pod wpływem żadnego czynnika może ponownie się źródła.
3. Jeśli connect elektrody do zawiesiny i prądu, kationy zacznie się przesuwać do elektrody ujemnej – katodę i anionów dodatnio naładowany – anody. Dlatego substancje są łatwo rozpuszczalne w wodzie, przewodzenia elektryczności lepiej niż sama woda. Z tego samego powodu nazywane są elektrolity.
4. Stopień dysocjacji elektrolitu charakteryzuje zawartość procentową substancji poddanej rozpuszczenia. Ta ilość zależy od rozpuszczalnika i właściwości substancji rozpuszczonej, stężenie tego ostatniego i temperatury zewnętrznej.
Tutaj, w rzeczywistości, a wszystkie podstawowe założenia tej prostej teorii. Ich użyjemy w tym artykule znajduje się opis tego, co dzieje się w roztworze elektrolitu. Przykładami takich związków Przyjrzyjmy się nieco później, a teraz rozważmy inną teorię.

Kwasy i zasady Lewisa teorii
Według teorii dysocjacji elektrolitycznej, kwas – substancje obecne w roztworze, którego kation wodoru i podstawa – związek rozkłada się w roztworze wodorotlenku anionu. Jest jeszcze inna teoria, nazwana na cześć słynnego chemika Gilbert Lewis. To pozwala na rozszerzenie koncepcji kilku kwasów i zasad. Według teorii Lewisa, kwas – to, że jony i molekuły substancji, które mają wolne orbitali elektronów i są zdolne do przyjęcia elektronu z inną cząsteczką. Łatwo się domyślić, że podstawy będą te cząsteczki, które są w stanie dać jednego lub więcej elektronów do „stosowanie” kwasem. To ciekawe jest to, że kwas lub zasada może być nie tylko elektrolit ale także każda substancja, która nawet nierozpuszczalna w wodzie.

Teoria Protolytic Brendsteda Lowry
W 1923 roku, niezależnie od siebie, dwóch naukowców – J. T. Lowry Bronsteda -predlozhili teorią, która jest aktywnie wykorzystywane przez naukowców opisują procesy chemiczne. Istotą tej teorii, że dysocjacja sposób sprowadza się do przeniesienia protonu z kwasu do zasady. Tak więc, ten ostatni jest tu rozumiane jako akceptora protonów. Następnie kwas jest ich dawcy. Teoria ta wyjaśnia również obecność substancji, które wykazują dobre właściwości i kwasy i zasady. Związki te zwane są amfoteryczne. Teoretycznie Bronsteda-Lowry'ego ich termin odnosi się także amfolitów, natomiast z kwasem lub zasadą powszechnie zwanych protolit.
Doszliśmy do następnej sekcji. Tutaj dowiesz się, co różne mocne i słabe elektrolity pokazać i omówić wpływ czynników zewnętrznych na ich właściwości. A następnie przejść do opisu ich praktycznego zastosowania.
Silne i słabe elektrolity
Każda substancja reaguje z samą wodą. Niektóre rozpuścić (np, chlorek sodu), a niektóre z nich nie rozpuszczają się (na przykład kredę). Tak więc wszystkie substancje dzielą się silnych i słabych elektrolitach. Te ostatnie są substancje, które oddziałują z wodą i źle osadzonym w dolnej części roztworu. Oznacza to, że mają one bardzo niski stopień dysocjacji wiązań o wysokiej energii, który pozwala cząsteczka rozpadają się na swoje jonów składowych w normalnych warunkach. Dysocjacja słabe elektrolity zachodzi powoli się lub zwiększa temperaturę i stężenie substancji w roztworze.
Mówić o silnym elektrolitem. Obejmują one wszystkie rozpuszczalne sole, a także silne kwasy i zasady. Są łatwe do rozbicia na jony i bardzo trudno jest zebrać je w deszczu. Prądu w elektrolicie, nawiasem mówiąc, są prowadzone dzięki jonów zawartych w roztworze. Dlatego najlepszym przewodzące silne elektrolity. Przykłady tego ostatniego: silne kwasy, zasady, sole rozpuszczalne w wodzie.
Czynniki wpływające na zachowanie elektrolitów
Spójrzmy teraz, w jaki sposób zmiana wpływa na środowisko zewnętrznych na właściwości substancji. Stężenie bezpośrednio wpływa na stopień dysocjacji elektrolitu. Ponadto, związek ten może być wyrażone matematycznie. Prawo, które opisuje związek ten, zwany prawo rozcieńczeniu Ostwalda jest zapisana jako: A = (K / C) 1/2. W tym przypadku – jest stopień dysocjacji (traktowane jako ułamek), K – stała dysocjacji, różne dla każdej substancji i – stężenie elektrolitów w roztworze. Według tej formuły, można dowiedzieć się wiele o materii i jej zachowanie w roztworze.
Ale odeszły od tematu. Dalsze stężenie od stopnia dysocjacji elektrolitu ma również wpływ na temperaturę. Dla większości substancji zwiększenie zwiększa rozpuszczalność i reaktywność. To może tłumaczyć występowanie pewnych reakcjach tylko przy podwyższonej temperaturze. W normalnych warunkach, są one albo bardzo powoli, albo w obu kierunkach (proces ten nazywany jest odwracalny).
Zbadaliśmy czynniki, które determinują zachowanie systemu, takich jak roztwór elektrolitu. Teraz możemy przejść do praktycznego zastosowania są bez wątpienia bardzo ważnych substancji chemicznych.
zastosowanie przemysłowe
Oczywiście każdy słyszał słowo „elektrolit” w odniesieniu do baterii. W pojeździe za pomocą akumulatorów ołowiowo-kwasowych, elektrolit, w której przeprowadza się w rolę 40 procent kwasu siarkowego. Aby zrozumieć, dlaczego tam jest wszystko, czego potrzebujesz to substancja niezbędna do zrozumienia funkcji akumulatora.
Więc jaka jest zasada działania każdej baterii? W odwracalnych reakcji, która ma miejsce konwersja jednej substancji do innej, w wyniku których uwalniają się elektrony. Gdy zachodzi interakcja naładowania akumulatora substancje, co jest niemożliwe w warunkach normalnych. Może być reprezentowane nagromadzenia energii w materiale w wyniku reakcji chemicznej. Podczas rozładowania w odwrotnej transformacji rozpoczyna zmniejszenie systemu do stanu początkowego. Te dwa procesy, tworzą razem jeden cykl ładowania i rozładowania.
Pod uwagę powyższy proces jest specyficzny przykład – akumulator kwasowo-ołowiowy. Jak łatwo się domyślić, źródło prądu składają się z elementu, zawierający ołów (diokisd i ołowiu PbO 2) oraz kwasu. Wszelkie bateria składa się z elektrody i przestrzeń między nimi wypełniona tylko elektrolitu. Ponieważ te ostatnie, jak to widać, w tym przykładzie zastosowano stężenie kwasu siarkowego wynosi 40 procent. Katoda baterii wykonane z dwutlenku ołowiu, anoda wykonana jest z czystego ołowiu. Wszystko to dlatego, że te dwa różne elektrody występuje odwracalne reakcje obejmujące jony są kwas zdysocjowanej:
- PbO + 2 SO 4 2 ~ + 4H + + 2e – = PbSO 4 + 2H 2O (reakcja zachodzi na ujemnej elektrodzie – katoda).
- Pb + SO 4 2 – 2e – = PbSO4 (reakcja zachodzi na dodatniej elektrodzie – anoda).
Jeśli czytasz reakcję od lewej do prawej – dostać procesy zachodzące podczas rozładowania baterii, a jeśli w prawo – za dodatkową opłatą. Każdy chemiczny źródło prądu z tych reakcji jest różny, ale mechanizm ich występowania ogólnie opisuje to samo w Istnieją dwa sposoby, z których jeden elektrony „absorbowane”, a z drugiej strony, przeciwnie „Idź”. Najważniejszą rzeczą jest to, że liczba zaabsorbowanych elektronów równa liczbie opublikowanych.
Faktycznie, oprócz baterii, istnieje wiele zastosowań tych substancji. W ogóle, elektrolitów, przykłady które dały – to tylko ziarna różnych substancji, które są zjednoczeni pod tym terminem. Otaczają nas wszędzie, wszędzie. Na przykład, ludzkie ciało. Czy uważasz, że nie istnieją takie substancje? Bardzo źle. Można je znaleźć wszędzie w nas i stanowią największą ilość elektrolitów we krwi. Obejmują one, na przykład, jony żelaza, które są częścią hemoglobiny i pomaga transportu tlenu do tkanek w organizmie. elektrolity krwi odgrywają również kluczową rolę w regulacji równowagi wodno-solnej i pracy serca. Funkcja ta jest wykonywana przez jony potasu i sodu (to jest jeszcze procesem, który występuje w komórkach, które są nazwane pompa potasowo-sodowego).
Każda substancja, które są w stanie rozpuścić przynajmniej trochę – elektrolity. I nie ma przemysłu i nasze życie, wszędzie tam, gdzie są stosowane. Jest to nie tylko akumulatory w samochodach i baterii. Jest każda substancja chemiczna i spożywcza, zakłady wojskowe, fabryki odzieży i tak dalej.
Skład elektrolitu, nawiasem mówiąc, jest inna. Tak więc, jest możliwe przyporządkowanie elektrolitu kwasowego i zasadowego. różnią się zasadniczo w swych właściwościach: jak wspomniano, są kwasy protonowe dawców, i zasady – akceptory. Ale w miarę upływu czasu, zmiany składu elektrolitu z powodu utraty części stężenia substancji albo Równoczesna (wszystko zależy od tego, co utracone, wody lub elektrolitu).
Codziennie spotykamy się z nimi, ale bardzo niewiele osób wie dokładnie definicję takiej perspektywie jako elektrolitów. Przykłady konkretnych substancji, które omawialiśmy, więc przejdźmy do nieco bardziej skomplikowanych pojęć.

Właściwości fizyczne elektrolitów
Teraz o fizyce. Najważniejszą rzeczą, aby zrozumieć, w badaniu tym temacie – prąd jest przekazywany do elektrolitów. Decydującą rolę w tym odgrywają jony. Te naładowane cząstki mogą migrować z jednego roztworu do drugiego ładunku. Tak więc, zazwyczaj aniony zawsze dodatniej elektrody i kationy – do negatywnej. Tak więc, przez działanie na roztwór elektrycznego obecnego dzielimy ładunki na przeciwległych stronach układu.
Bardzo interesujące cechy fizyczne, takie jak gęstość. To wpływa na wiele właściwości omawianych naszych związków. I często pojawia się pytanie: „Jak zwiększyć gęstość elektrolitu” W rzeczywistości, odpowiedź jest prosta: jest to konieczne w celu obniżenia zawartości wody w roztworze. Ponieważ gęstość elektrolitu zależy głównie gęstości kwasu siarkowego, w dużej mierze zależą od stężenia końcowego. Istnieją dwa sposoby, aby zrealizować plan. Pierwszym z nich jest dość prosta: zagotować elektrolit znajdujący się w akumulatorze. Aby to zrobić, trzeba ładować go tak, że temperatura wewnątrz wzrosła nieznacznie powyżej stu stopni Celsjusza. Jeśli ta metoda nie działa, nie martw się, nie ma innego: po prostu zastąpić stary nowy elektrolit. W tym celu należy opróżnić starego roztworu do czyszczenia wewnętrznych powierzchni pozostałego kwasu siarkowego w wodzie destylowanej, a następnie wlać do nowej porcji. Zazwyczaj jakości roztworów elektrolitów bezpośrednio uzyskać pożądaną wartość stężenia. Po wymianie można zapomnieć o tym, jak podnieść gęstość elektrolitu.
Skład elektrolitu w dużej mierze decyduje o jego właściwościach. Cechy, takie jak przewodnictwo elektryczne i gęstości, na przykład, silnie zależy od charakteru substancji rozpuszczonej i jego stężenia. Istnieje odrębna kwestia ile elektrolitu w akumulatorze może być. W rzeczywistości, jego objętość jest bezpośrednio związane z deklarowanej wydajności produktu. Bardziej kwas siarkowy wewnątrz akumulatora, jest więc bardziej skuteczne, t. E. więcej napięcia jest w stanie wytworzyć.

Gdzie to jest przydatne?
Jeśli jesteś entuzjastą samochodu lub po prostu interesują się samochodami, można zrozumieć wszystko samemu. Chyba nawet wiem, jak określić, ile elektrolitu w akumulatorze jest teraz. A jeśli jesteś z dala od samochodu, to wiedza o właściwościach tych substancji, ich użytkowania oraz w jaki sposób współdziałają ze sobą nie będą zbędne. Wiedząc o tym, nie jesteś zdezorientowany, zostaniesz poproszony powiedzieć co elektrolitu w akumulatorze. Chociaż nawet jeśli nie jesteś entuzjastą samochód, ale masz samochód, to wiedza o urządzeniu baterii będzie absolutnie nie zaszkodzi a pomoże naprawić. To będzie o wiele łatwiej i taniej jest zrobić wszystko samemu, niż iść do centrum samochodem.
I dowiedzieć się więcej na ten temat, zalecamy sprawdzić podręcznik chemii dla szkół i uniwersytetów. Jeśli znasz tę naukę i dobrze czytać wystarczająco dużo książek, najlepszym rozwiązaniem będzie „Źródła mineralne” Varypaeva. Nie zostały określone szczegółowo całą teorię życia baterii, różnych baterii i elementów wodorowych.
wniosek
Doszliśmy do końca. Podsumujmy. Powyżej omówiliśmy wszystko, co ma czegoś takiego jak elektrolity: przykłady, teorii struktury i właściwości, funkcji i zastosowań. Po raz kolejny, należy stwierdzić, że związki te są częścią naszego życia, bez którego nie może istnieć, naszego ciała i wszystkich dziedzinach przemysłu. Pamiętasz elektrolitów we krwi? Dzięki nim żyjemy. A co o naszych samochodach? Dzięki tej wiedzy możemy rozwiązać każdy problem z baterią, jak teraz zrozumieć, jak zwiększyć gęstość elektrolitu w nim.
Wszystko da się powiedzieć, ale nie ustawiony taki cel. Po tym wszystkim, to nie wszystko, co można powiedzieć o tych niezwykłych substancji.