roztwory elektrolitów są specjalne ciecze, które są częściowo lub całkowicie w postaci naładowanych cząstek (jony). Sam proces rozdzielania cząsteczek o (ujemnie aniony) i dodatnio naładowane (kationów) cząstki zwane elektrolityczna dysocjacja. Dysocjacji w roztworze jest możliwe dzięki zdolności jonów do interakcji z cząsteczkami cieczą polarną, który działa jako rozpuszczalnik.
Jakie są elektrolity
 roztwory elektrolitów są podzielone na wodne i nie-wodne. Woda studiował całkiem dobrze i były bardzo rozpowszechnione. Są niemal w każdym żywym organizmie i aktywnie uczestniczy w wielu ważnych procesach biologicznych. Niewodnych elektrolitów zastosowanie w procesach elektrochemicznych i różnych reakcji chemicznych. Ich stosowanie doprowadziło do wynalezienia nowych źródeł energii chemicznej. Odgrywają one ważną rolę w komórkach fotoelektrochemicznych, syntezie organicznej, kondensatory elektrolityczne.
roztwory elektrolitów są podzielone na wodne i nie-wodne. Woda studiował całkiem dobrze i były bardzo rozpowszechnione. Są niemal w każdym żywym organizmie i aktywnie uczestniczy w wielu ważnych procesach biologicznych. Niewodnych elektrolitów zastosowanie w procesach elektrochemicznych i różnych reakcji chemicznych. Ich stosowanie doprowadziło do wynalezienia nowych źródeł energii chemicznej. Odgrywają one ważną rolę w komórkach fotoelektrochemicznych, syntezie organicznej, kondensatory elektrolityczne.
Roztwory elektrolitów, w zależności od stopnia dysocjacji można podzielić na silne, średnich i słabych. stopień dysocjacji (α) – oznacza stosunek rozbitych cząsteczek naładowanych cząstek do całkowitej liczby cząstek. W mocnych elektrolitach, wartość alfa w pobliżu 1, w środkowym α≈0,3 i słabej alfa <0,1.
Ogólnie silne elektrolity obejmują sole, kilka określonych kwasów – HCI, HBr, HI, HNO3, H 2SO 4, HCIO4, wodorotlenek baru, strontu, wapnia i metali alkalicznych. Inne zasady i kwasu – średni elektrolit lub osłabienia siły.
roztwory elektrolitów Properties
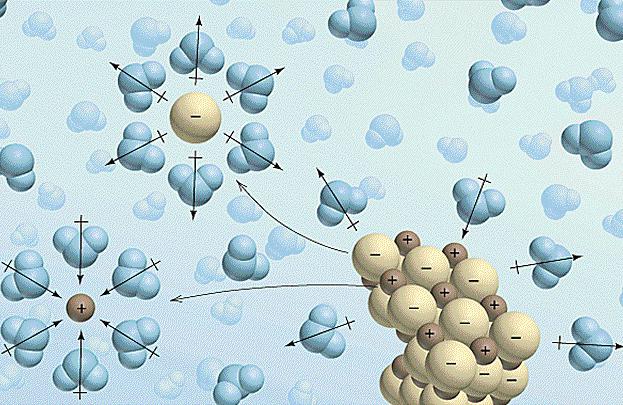 Rozwiązania edukacyjne są często towarzyszą efekty cieplne i zmian w objętości. Proces rozpuszczania elektrolitu w cieczy odbywa się w trzech etapach:
Rozwiązania edukacyjne są często towarzyszą efekty cieplne i zmian w objętości. Proces rozpuszczania elektrolitu w cieczy odbywa się w trzech etapach:
- Zniszczenie wiązań chemicznych i międzycząsteczkowe rozpuszczony elektrolit koszty wymaga pewnej ilości energii cieplnej, a tym samym wchłanianie występuje (H nieco?> 0).
- W tym etapie rozpuszczalnik zaczyna wchodzić w interakcje z jonami elektrolitycznych, w wyniku tworzenia się solwatu (w roztworze wodnym – hydraty). Sposób ten jest znany i jest egzotermiczna solwatacji, tj Występuje egzoterma (A H hydr <0).
- Ostatni etap – dyfuzja. Ten jednorodny rozkład hydratów (solwaty), w roztworze, w masie. Proces ten wymaga nakładów energii i w związku z tym roztwór chłodzi się (różnicowy H> 0).
Zatem całkowity efekt cieplny rozpuszczenie elektrolitu można zapisać w następującej postaci:
Zol H = H + H rozładowania różnicy hydraulicznego H +
Z tego, co byłoby składniki efektów energetycznych zależy od końcowej oceny całkowitego ciepła rozpuszczania efektu elektrolitu. Zwykle proces ten jest endotermiczne.
 Właściwości rozwiązania zależy przede wszystkim od charakteru jego elementów składowych. Ponadto, właściwości kompozycji w postaci roztworu elektrolitu zależy, ciśnienia i temperatury.
Właściwości rozwiązania zależy przede wszystkim od charakteru jego elementów składowych. Ponadto, właściwości kompozycji w postaci roztworu elektrolitu zależy, ciśnienia i temperatury.
W zależności od zawartości wszystkich roztworów substancji rozpuszczonych elektrolitów, może być podzielony w bardzo rozcieńczonych (w którym zawiera tylko ślady „elektrolit”) rozcieńczony (zawierające niewielkie ilości substancji rozpuszczonej) i zatęża (ze znaczną zawartością elektrolitu).
Reakcje chemiczne w roztworach elektrolitów, które są powodowane przez przepływ prądu elektrycznego prowadzi do izolacji niektórych materiałów elektrod. Zjawisko to nazywane jest elektroliza i jest często stosowane w nowoczesnym przemyśle. W szczególności, uzyskuje się w wyniku elektrolizy aluminium, wodór, chlor, wodorotlenek sodu, nadtlenek wodoru, i wiele innych ważnych substancji.












