Jak konfigurację elektroniczną potasu? Aby odpowiedzieć na to pytanie, należy rozważyć budowę atomu i zasad dystrybucji elektronów na poziomach i podpoziomów.
mechanika kwantowa
Elektroniczny układ potasu równanie opisane Schrödinger'a. Łączy się energię potencjalną oddziaływania jądra i elektronów i wielkości odpychania pomiędzy cząstkami posiadających taki sam ładunek. mechaniki kwantowej wykorzystuje to równanie to wyjaśnienia obecności każdego poziomu energii z zapasu energii.
atomy wielu elektronów
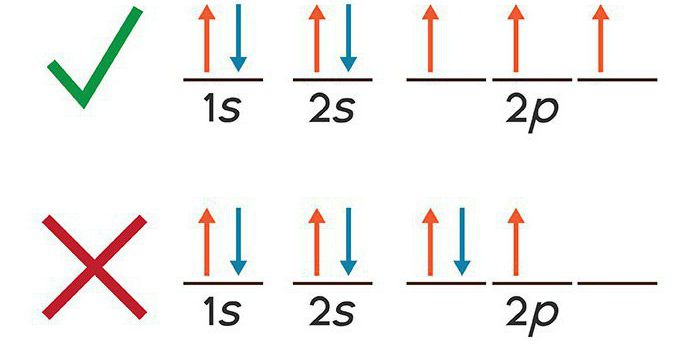
Elektroniczny układ potasu jest napisany z zasadą Pauliego. Ze względu na właściwości o charakterze falowym elektronów, to przyjmuje się, że każda cząstka ujemny znajduje się na „orbitalnej”, to znaczy, że ma pewną istnienie przestrzennego. W odniesieniu do węgla wielu elektronów, które zawierają potas, na każdej części okrężnej, nie mogą znajdować się więcej niż dwa elektrony. W rezultacie zostało przydzielone cztery kwantowe liczby charakteryzujące stan elektronu w badanym przedziale czasowym.
zasada Aufbau
Elektroniczny układ potasu dokonuje się na podstawie zasad wynikających Klechkovskaya. Rozważmy to w sposób bardziej szczegółowy. W zależności od tego, co orbitalne elektrony są rozmieszczone, mają pewną rezerwę energii. Po pierwsze, nie jest rozkład cząstek o mniejszej zasilania.
W podstawowej charakterystyki energii elektronów służy główny liczbę kwantową, odpowiadającej liczbie okresu.
Wiele-przyciąganie elektronów atomu występuje nie tylko dla elektronów rdzenia, ale również odpychania pomiędzy nimi. Przez zwiększenie całkowitej cząstek wirowania zmniejsza energię powłoka elektronowa zwiększa liczbę elektronów o takiej samej orientacji własnego ruchu momentach. Taka zależność w chemii kwantowej nazywa zasadę Hund użytkownika.
Na podstawie tych dwóch zasad opracowanych konfigurację elektroniczną i atom potasu. Widma atomowe pozwalają na określenie stanu podstawowego elektronów, to znaczy, aby zidentyfikować te cząstki, które mają minimalny rezerw energetycznych.
Istotą budowy wzór elektronicznego atom wielu elektronów potasu jest bardzo proste: elektroniczny system musi mieć minimum energii odpowiada zasadniczo Pauliego.
Przykłady rozkładu elektronów poziomów energetycznych
Przed przystąpieniem do badania, co jest konfiguracja elektronowa jonów potasu prosty przykład. Atom wodoru rdzeń zawiera jeden pozytywny protonowej. Wokół rdzenia jest obracany o jedno okrążenie elektronów. Stan podstawowy o wzorze wodoru jest następujący: 1s. Rozważmy funkcje orientacji spinu tego elektronu. Według reguły Hund jest, to codirectional ze spinu jądrowego.
Helu o drugą liczbę sekwencji w elementach tabeli na dwóch elektronów orbitali audio. Każdy z nich ma ½ wirowania, ma inny kierunek obrotów.
W elementach do drugiego poziomu energetycznego pojawia dwie powłoki, z których każdy ma swoje własne magazynowania energii.
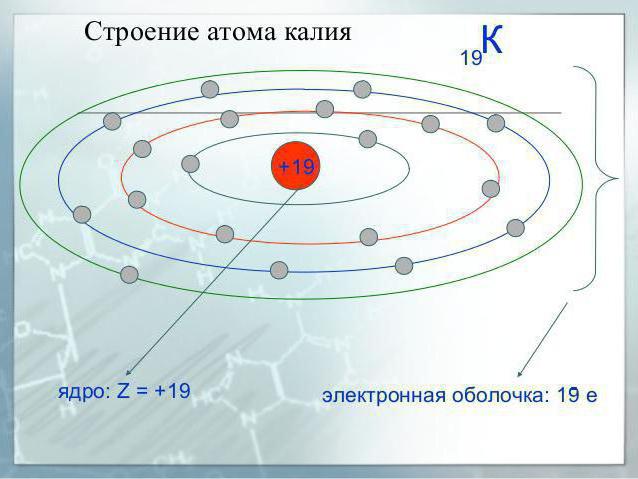
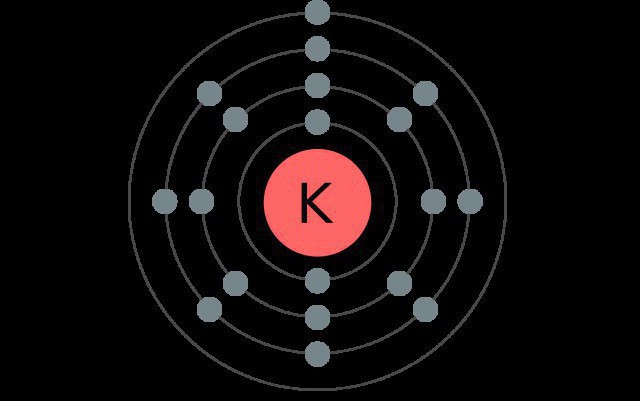
Potasu element czwartego okresu elementy systemu, a więc ma cztery poziomy elektronicznych, z których każda zawiera różne rodzaje podpoziomami.
W normalnym stanie atom metalu alkalicznego ma następującą konfigurację: 1s22s22p63s23p64s1.
Elektroniczny układ jonów potasu jest różny od atomu. Na zewnętrznym poziomie energetycznym metalu jest wartościowość elektronów. Ponieważ potasu wykazuje zmniejszenie właściwości podczas interakcji z innymi atomami, wysyła elektron wartościowość przekształca się jon dodatni (kation) o następującej konfiguracji: 1s22s22p63s23p64s0 elektronicznego.
wniosek
Dla każdego pierwiastka chemicznego, znajduje się w układzie okresowym mogą tworzyć konfiguracje elektronowe, reguła zbrojnych Hund, tym zakaz Pauliego i twierdzi Klechkovskii. Oprócz konfiguracje elektronowe atomów w chemii nieorganicznej i stanowią aniony kationy wzorze a wynikające z oddziaływań chemicznych.












