Wpływ różnych substancji chemicznych na organizm człowieka jest niejednoznaczna. Większość z nas znane związki lub neutralny, i odgrywają pozytywną rolę w życiu człowieka. Ale jest grupa substancji, co stanowi poważne zagrożenie dla zdrowia. Są one podzielone na kilka klas. Rozważyć w tym artykule kwas arsenowy – jedna z tych substancji toksycznych. Zgodnie z obecnie przyjętą klasyfikacją, jest zawarty w drugiej grupy wysokiego ryzyka, wraz z chloroformem, ołowiu i litu związków. Badamy właściwości kwasu arsenu bardziej szczegółowo.
Struktura cząsteczkowa i stan skupienia materii
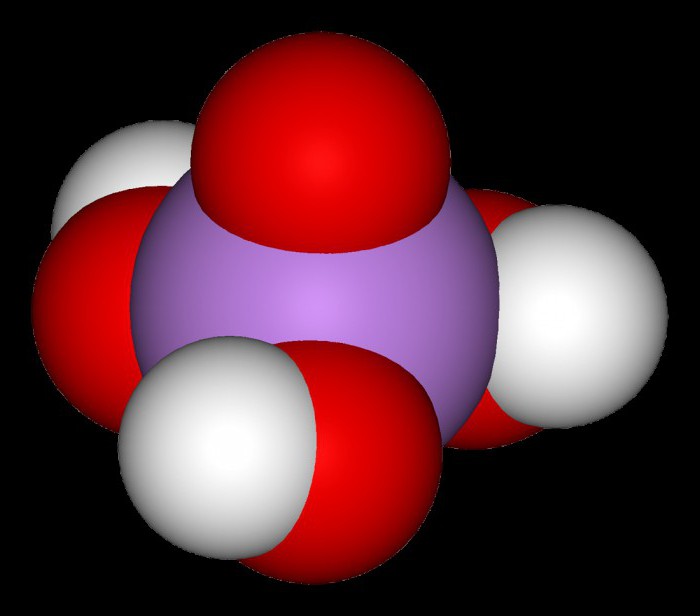
Związek ten w normalnych warunkach ma strukturę krystaliczną. Jako trójzasadowym, kwas arsenowy, przy czym wzór CH3 Aso 4 ma obydwu drugorzędowych i sole z kwasami. Na przykład, gidroarsenat potasu – K 2 HASO 4 digidroarsenat sodu – NaH, 2 Aso 4 arsenian litowo – litowo 3 Aso 4. Kalcynowanie kwas arsenowy, arsen otrzymuje się gemipentoksid zwane pięciotlenek arsenu. Jego biała przezroczyste kryształy tworzą szklistą masę, jest słabo rozpuszczalny w wodzie.
dysocjacja
H3AsO 4, wraz z kwasu mrówkowego i wodorotlenku ołowiu umiarkowanie słaby elektrolitu. Tak więc, w tabeli kwasu jak największe Kwasy jonizację ortomyshyakovaya trzy stałe dysocjacji 5.6 x 10 ~ 3, 1,5 x 10 ~ 7 3 89 X 10 -12. Wskaźniki te scharakteryzować ilościowo siły kwasu. Zgodnie z stałe dysocjacji w wielu kwasów nieorganicznych CH3 Aso 4 zajmuje położenie pomiędzy chromu i kwasu antymonu. Rosyjski chemików eksperymentatorów Al i I. L. Agafonovy formułowane wyrażenie matematyczne, w którym pierwszy i drugi związek pochodzący stałej dysocjacji kwasu arsenu od temperatury w zakresie od 0 ° C do 50 ° C
zwłaszcza właściwości chemiczne
Stopień utleniania arsenu atomów tworzących cząsteczkę kwasu, to 5. Odnosi się to do faktu, że ten związek sam w reakcje chemiczne z innymi substancjami wykazują właściwości utleniających. W ten sposób, podczas jego współdziałania z jodku potasu działając jako środka redukującego, w środowisku kwaśnym znaleźć kwas arsenawy oznacza H 3 ASO 3 spośród produktów reakcji. Przypomnijmy, że kwas arsenowy, przy czym wzór CH3 Aso 4 jest trójzasadowy, a co za tym idzie, reakcje z zasadami alkalicznymi lub nierozpuszczalna, można ją otrzymać trzy rodzaje soli: nośnik, woda, digidroarsenaty. Jakościowa reakcja ASO 4 3 jonów w chemii analitycznej samej interakcji jest kwas arsenowy lub jego sole rozpuszczalne sole srebra, takie jak azotan. W wyniku obserwacji wytrącania Ag 3 Aso 4 kolor kawy.
metoda jodometryczna do oznaczania kwasu arsenowego
W chemii analitycznej, ważnym zadaniem jest wykrywanie związków chemicznych w roztworach. Arsen kwasowe właściwości chemiczne które omówione wcześniej, można wykryć mikrometoda jodometrycznie. Do 1 ml jego roztwór wlewa się taką samą objętość 4N. kwasu solnego i 1 ml 4% roztworu jodku potasu. Tworzą arsen półtoratlenek W 2 O 3, których masa na ściśle określonych stosunkach ilościowych substancji jest zawsze taka sama i wynosi 0.5746 mg.

Zdolność utleniająca kwasu arsenowego
Jak wiadomo, H-3 Aso 4 jak kwas ortofosforowy, elektrolit o średniej wytrzymałości. Jej białe przezroczyste kryształy rozpływająca się i formułuje 2H 3 Aso 4 x H2O jego sole utworzone z metali alkalicznych (jak średnia i kwasu), w wodne roztwory mają pH większe niż 7. arseniany litu, potasu, sodu i amonu dobrze rozpuszczalne w wodzie, a reszta środka sól nie rozpuszcza się w nim. kwas arsen – dobry utleniacz. W reakcjach redox, jest doprowadzony do kwasu arsenawy lub wodorku arsenu.
H 3 w Aso 4 + 2e + 2H + = CH3 ASO 3 + H2O
H 3 w Aso 4 + 8e + 8H + + 3 = AsH 4H 2O
Ponadto, kwas arsenowy łatwo utlenia się różne metale, siarczyn i kwasu jodek i siarkowodoru.

Wytwarzanie kwasu arsenowego
W warunkach laboratoryjnych, H-3 Aso 4 można otrzymać przez reakcję arsenu seskwitlenek kwasem azotowym z ogrzewaniem. Produkty wykrywane tlenek azotu i H 3 ASO 4. Innym sposobem wytwarzania – to rozpuszczenie w wodzie tlenek arsenu. Najczęściej stosowane do uzyskania bardzo jednoczesnego utleniania i hydrolizy trialkilarsenitov ogrzewano do 50 ° C w roztworze nadtlenku wodoru. Równolegle, mieszaninę reakcyjną wyjmuje się z wody i alkoholu. Następnie roztwór odparowuje się, a otrzymany kwas o wysokiej czystości, arsen. W naturze, surowiec dla kwasu arsenu są minerały arsenolite i arsenopirycie, które są bogate w złoża Czelabińsku i Chita Region Federacji Rosyjskiej.
H3AsO4 aplikacja
Biorąc pod uwagę fakt, że ortomyshyakovaya kwas jest jednym z najsilniejszych trucizn. Jego zastosowanie w przemyśle i życiu codziennym jest ograniczona. Bardziej powszechne sól – arseniany, których toksyczność jest znacznie mniejsza niż w przypadku większości CH3 ASO 4. Tak więc, w przemyśle przetwórstwa drewna z siarczanem cynku i pentachlorofenol soli sodowej kwasu arsenu stosuje się do impregnacji drewna. Metoda ta minimalizuje straty przed zniszczeniem zakażeń grzybiczych celulozy i larwy chrząszczy, szkodnikom drewna. W medycynie H 3 Aso 4 stosuje się w „Atoxil” preparatu do leczenia zakażeń pierwotniakowych, takich jak giardiazy, balantidioza, izosporydozy.

Należy zauważyć, że zainfekowany populacja tych zakażeń w ostatnich latach dramatycznie wzrosła. Istnieje kilka powodów, – na przykład, zakażenie żywności zawierającej zarodniki pierwotniaki, ukąszeniami owadów lub drogą płciową. kwas arsenu stosuje się jako materiał wyjściowy w procesie produkcji soczewek optycznych, jak i w elektrotechnice. Pochodna CH3 Aso 4 – jego sól sodowa, są z powodzeniem stosowane w dermatologii i gruźlica. Związki stosowane w stomatologii arsenu (pasty arsenu) jako leku stosowanego do obniżenia wrażliwości na ból z zapaleniem nerwu przy usuwaniu z kanału zęba.
Działanie kwasu na organizm ludzki
Jak wspomniano wcześniej, H-3 Aso 4 zawarty w drugiej klasy zwiększonego zagrożenia – bardzo niebezpiecznych substancji. Uważana za śmiertelną dawkę zarówno kwasu i jego soli, w zakresie od 15 do 150 mg na kilogram ciała ludzkiego. Się wraz ze wspólnym efektem toksycznym, kwas arsenowy powoduje martwicę skóry i błon śluzowych narządów wewnętrznych: płuc, żołądka, jelit.
W laboratorium, w eksperymentach z arsenianu i H3 w Aso 4 wymagane jest stosowanie ochronnych rękawic i same eksperymenty przeprowadzano pod wyciągiem. W przypadku poziomu toksyczności komórkowej naruszyła układ enzymatyczny inaktywacji enzymów. U ludzi, zatrucie arsenian prowadzi do niedowładu lub nawet paraliż. W onkologii chemioterapii z nieprzestrzegania schematów dawkowania leków i przypadków zatruć miarsenolom novarsenolom rejestrowane. Pierwsza pomoc w przypadku soli zatrucie kwasem arsenu jest natychmiastowe płukanie żołądka (np unitiola sodowego lub dwutlenku krzemu preparatów).

Do zapobiegania ostrej niewydolności nerek, hemodializa jest wymagane. Antidotum oprócz unitiola roztworu 5%, to możliwe jest stosowanie środka zabezpieczającego Strizhevskaya. Przed przybyciem awaryjnej pierwszej pomocy w domu, aby zmniejszyć stopień zatrucia można stosować roztwór kwasu cytrynowego, a następnie wywoływać wymioty i pranie żołądka. Wszystkie środki lecznicze powinny być wykonywane zgodnie z normami leżenia w łóżku pod nadzorem lekarza.











