Odkrycia w dziedzinie struktury atomowej ważnym etapem w rozwoju fizyki. Wielkie znaczenie było modelu Rutherforda. Atom jako układ cząstek i jej składników badano w większym stopniu i w szczegółach. Sytuacja ta doprowadziła do pomyślnego ustanowienia nauki jak fizyka jądrowego.
Starożytne idee o strukturze materii
Założenie, że ciała otaczające składa się z maleńkich cząstek, które zostały wykonane w czasach starożytnych. Myślicieli czym atom reprezentowane najmniejszych niepodzielnych cząstek jakiejkolwiek substancji. Argumentowali oni, że nie ma nic we wszechświecie jest mniejsze od atomu. Takie poglądy są utrzymywane przez wielkich greckich naukowców i filozofów – Demokryta, Lukrecjusza, Epikura. Hipotezy te myślicieli dziś zjednoczone pod nazwą „antyczny atomizmu”.
średniowieczne reprezentacje
najdawniejszych czasów minęło, a w średniowieczu byli również naukowcy, którzy wyrazili różne założenia dotyczące struktury materii. Jednak przewaga religijnych i filozoficznych poglądów władzy kościelnej w okresie historii w zarodku Każda próba powstrzymania i aspiracje ludzkiego umysłu do materialistycznych ustaleń naukowych i odkryć. Jak wiadomo, średniowieczna inkwizycja bardzo nieprzyjazny zachowywał się z przedstawicielami świata nauki w tym czasie. Pozostaje powiedzieć, że te dni były jasne umysły pochodzi z dawnej idei niepodzielności atomu.
Badania grupy wiekowe 18-19
18 wieku został oznaczony przez największych odkryć w dziedzinie podstawowej struktury materii. W dużej mierze dzięki staraniom naukowców, takich jak Antuan Lavuaze Michaiła Łomonosowa i Dzhon Dalton. Niezależnie od siebie, byli w stanie udowodnić, że atomy istnieją naprawdę. Ale pytanie o ich wewnętrznej struktury pozostały otwarte. Koniec 18 wieku cechował tak znaczącym wydarzeniem w świecie naukowym, jak odkrycia D. I. Mendeleevym okresowego pierwiastków chemicznych. To był naprawdę potężny przełom, że czas, aby podnieść zasłonę przy założeniu, że wszystkie atomy mają taką samą naturę, że są one ze sobą powiązane. Następnie w 19 wieku, kolejnym krokiem w kierunku odkrycie struktury atomu dowody, że w skład każdej z nich jest obecny elektronów. Prace naukowców z tego okresu wyprodukował podatny grunt dla odkryć 20 wieku.
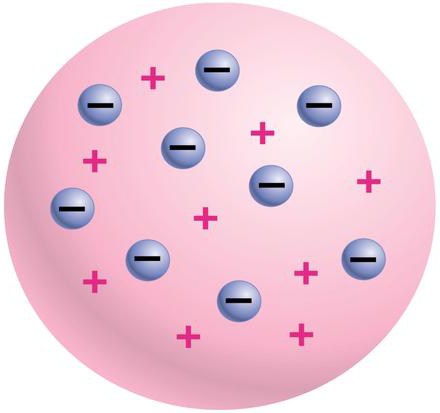
eksperymenty Thomson
Brytyjski fizyki Dzhon Tomson 1897 okazało się, że struktura atomów zawiera elektronów o ujemnym ładunku. Na tym etapie, to fałszywy pogląd, że atom – ograniczyć podzielność każdą substancję zostały ostatecznie zniszczone. Skąd Thomson był w stanie udowodnić istnienie elektronu? Naukowiec umieścić w swoich eksperymentach w bardzo rozrzedzone gazy elektrody i prąd elektryczny jest przepuszczany. Powoduje to, że promienie katodowe. Thomson starannie badane ich charakterystyki i stwierdził, że są one strumień naładowanych cząstek, które poruszają się z dużą prędkością. Naukowa prowadzi do obliczania masy tych cząstek i ich ładunku. On także okazało się, że nie może być przekształcona w obojętnych cząstek, a ładunek elektryczny – to podstawą ich charakteru. Więc były elektrony są otwarte. Thomson jest również twórcą pierwszego na świecie atomowego modelu konstrukcji. Zgodnie z nim, atom – skrzep naładowane dodatnio masy, które są rozmieszczone równomiernie naładowanych ujemnie elektrony. Wyjaśnia to ogólną strukturę atomów obojętnych, a przeciwległe koszty znoszą się wzajemnie. Eksperymenty Dzhona Tomsona się nieocenione znaczenie dla dalszego badania struktury atomu. Jednak wiele pytań pozostaje bez odpowiedzi.
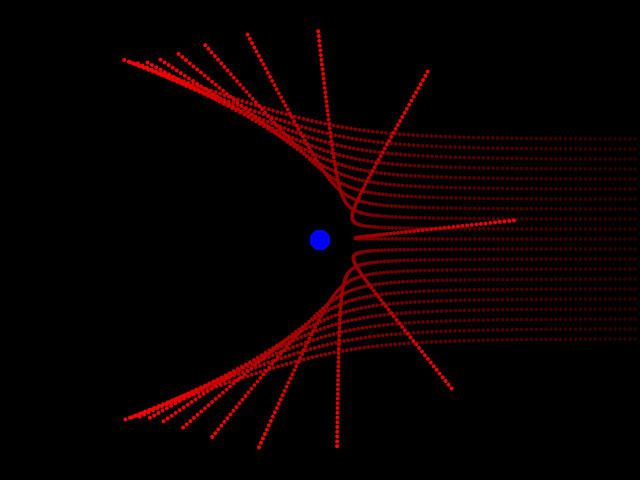
badania Rutherford
Thomson odkryto istnienie elektronów, ale nie może znaleźć się w atom dodatnio naładowane cząstki. Ernest Rutherford poprawił ten błąd w 1911 roku. Podczas doświadczeń badających działanie alfa cząstek w gazach, stwierdzono, że cząstki są w atomie, dodatnio naładowane. Rutherford Stwierdzono, że przez przepuszczenie gazu przez wiązkę lub przez cienką płytkę metalową jest ostre odchylenia o małej ilości cząstek z drogi ruchu. Oni po prostu odrzucił. Naukowiec sobie sprawę, że zachowanie to jest spowodowane zderzeniem z dodatnio naładowanymi cząstkami. Doświadczenia te pozwolą fizyków do modelowania struktury Rutherford atom.

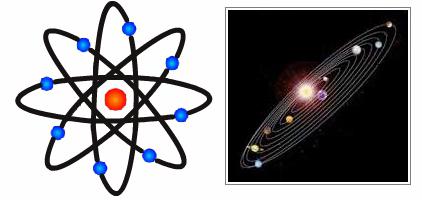
Model planetarny
Teraz Academic nieco różni się od założeń przyjętych przez Johna Thomsona. Różne modele ze stali i ich atomów. doświadczenie Rutherforda pozwoliło mu stworzyć zupełnie nową teorię w tej dziedzinie. Odkrycie naukowców były kluczowe dla dalszego rozwoju fizyki. Rutherford model opisuje atom jako rdzeń umieszczony w środku i poruszającego się wokół elektronów. Rdzeń ma ładunek dodatni i elektrony – ujemny. Model atom Rutherford zakłada elektronów obracające się wokół rdzenia w określonych torów – orbitach. Otwieranie naukowca pomogło wyjaśnić przyczyny odchylenia cząstki alfa i był impuls dla rozwoju jądrowego teorii atomu. W modelu atomu Rutherforda analogia z ruchem planet Układu Słonecznego wokół Słońca. Jest bardzo dokładny i żywy porównanie. Dlatego Rutherford modelu atomu, który porusza się po orbicie wokół jądra, został nazwany planetarnych.
Prace Niels Bohr
Dwa lata później, duński fizyk Niels Bohr próbował łączyć koncepcje struktury atomu z właściwości kwantowych światła. Model jądrowy Rutherforda atomu oddano naukowców w oparciu o jego nowej teorii. W Bohra atomy założenie obracać się wokół rdzenia w koliste orbity. Taki tor ruchu prowadzi do przyspieszenia elektronów. Ponadto interakcja z tymi cząstkami kulombowskie z atomu centralnego towarzyszy tworzenie i wydatki energii w celu zachowania pola elektromagnetycznego przestrzennej wynikające z ruchu elektronów. W takich warunkach, ujemnie naładowane cząstki powinny zawsze wchodzą w jądrze. Ale tak się nie dzieje, co wskazuje na większą stabilność atomów jak systemy. Niels Bohr sobie sprawę, że prawa termodynamiki klasycznej, opisane równaniami Maxwella nie działają w warunkach subatomowych. Dlatego naukowcy określone przynieść nowe przepisy, które utrudniałyby cząstek elementarnych na świecie.
Postulaty Bohra
Głównie ze względu na fakt, że nie był model Rutherford, atom oraz jego składniki zostały dokładnie przebadane Niels Bohra w stanie zbliżyć się do tworzenia jego postulatów. Pierwszy z tych stanów, które Atom stacjonarny stan, w którym nie zmienia, a tym samym energię elektrony poruszają się po orbicie bez zmiany jego trajektorii. Zgodnie z drugim postulatem przejście elektronu z jednej orbity do drugiego następuje izolacja lub pochłanianie energii. Jest ona równa różnicy energii pomiędzy poprzednich i kolejnych stanów atomu. W tym przypadku, jeśli elektron przeskakuje bliżej rdzenia oczodołu, jest emitowana energia (fotonów), i vice versa. Pomimo tego, że przepływ elektronów prawie przypomina tor orbitalny usytuowaną ściśle obwodowy otwór Bohra można uzyskać doskonałe wytłumaczenie istnienia widma liniowego atomu wodoru. W tym samym czasie, fizycy Hertz i Frank, który mieszkał w Niemczech potwierdził naukowiec Niels Bohr o istnieniu stacjonarnych stabilnych stanów atomu i możliwości zmian wartości energii atomowej.

Współpraca między tymi dwoma naukowcami
Nawiasem mówiąc, Rutherford przez długi czas nie mógł określić ładunek jądra. Naukowcy Marsden i Geiger próbował przeprowadzić roszczeń kontroli krzyżowej Ernest Rutherford, a w wyniku starannych i szczegółowych eksperymentów i obliczeń doszli do wniosku, że rdzeń główną cechą atomu i skupia cały swój ładunek. Później wykazano, że ładunek jądra jest liczbowo równa wartości liczby porządkowej pierwiastka w układzie okresowym D. I. Mendeleeva. Co ciekawe, Niels Bohr wkrótce spotkał się z Rutherford, w pełni zgodził się z jego poglądami. Następnie, naukowcy od dawna pracowali razem w tym samym laboratorium. Model Rutherforda atomu jako system składający elementarnych naładowane cząstki – wszystko Niels Bohr uznać za sprawiedliwe i wszystko odłożył swój elektroniczny model. Wspólne działania badawcze naukowców była bardzo udana i zaowocowała. Każdy z nich pogrążyła się badania właściwości cząstek elementarnych i poczyniła znaczące odkrycia w nauce. Później Rutherford odkrył i udowodnił możliwość rozszerzenia rdzenia, ale to już temat na inny artykuł.















