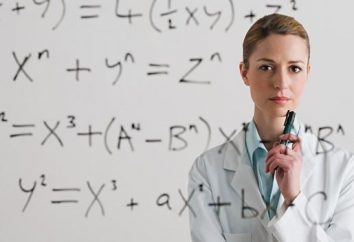Określenie „gazy rzeczywiste” wśród chemików i fizyków zwane gazy takie właściwości, która jest bezpośrednio zależna od ich międzycząsteczkowych. Chociaż każdy katalog wyspecjalizowane można odczytać, że jeden mol substancji w normalnych warunkach i stacjonarnie zajmuje objętość około 22,41108 litrów. To stwierdzenie jest prawdziwe tylko dla tak zwanych „idealnych” gazów, dla których, zgodnie z równaniem Clapeyrona, nie działają siły wzajemnego przyciągania i odpychania cząsteczek i objętości zajmowanej przez nią jest pomijalnie mały.

Oczywiście, substancje te nie istnieją, więc wszystkie te argumenty i obliczenia są orientacja czysto teoretyczna. Ale prawdziwy gazy, które są w pewnym stopniu odbiegać od idealnych przepisów są bardzo częste. Między cząsteczkami tych substancji są zawsze obecne siła wzajemnego przyciągania, co oznacza, że ich objętość jest nieco inny od wyprowadzona idealnego modelu. Co więcej, wszystkie prawdziwe gazy mają różne stopnie odchylenia od idealności.
Ale tu prześledzić zupełnie wyraźną tendencję: im wyższa temperatura wrzenia substancji bliskie zera stopni Celsjusza, tym bardziej związek będzie się różnić od idealnego modelu. Równanie stanu gazów rzeczywistych posiadanych przez holenderski fizyk Johannes Diederik van der Waalsa, zostały one wycofane w 1873 roku. W tym wzorze, które ma postać (p + n = 2 A / V, 2) (-) = nb nRT , podawano dwa bardzo znaczne zmiany w porównaniu z Clapeyrona (PV = NRT), ustalona doświadczalnie. Pierwszy uwzględnia siły oddziaływania cząsteczkowego, co wpływa nie tylko od rodzaju gazu, ale również jego wielkość, gęstość i ciśnienie. Drugi korekcji zależy od masy cząsteczkowej substancji.

Najistotniejsze korekty rola pozyskiwać dane przy wysokim ciśnieniu gazu. Na przykład, w atmosferze azotu w temperaturze 80 atmosfer wykładnikiem. Obliczenia będą różne od ideału o około pięć procent, podczas gdy ciśnienie wzrasta do różnicy czterech atmosfer osiągnęły już w stu procentach. Wynika z tego, że prawa idealnego modelu gazu są przybliżone. Odstępstwo od nich jest zarówno ilościowe jak i jakościowe. Pierwszy przejawia się w tym, że równanie Clapeyron odnosi się do wszystkich rzeczywistym gazowych bardzo brutalnie. Retreat jest jakościowy znacznie głębiej.
Prawdziwe gazy mogą być również przekształcone w ciekłym i stałym stanie skupienia, co byłoby niemożliwe w ich ścisłego przestrzegania równania Clapeyrona. międzycząsteczkowe siły działające w tych materiałów prowadzi do powstawania różnych związków chemicznych. To znowu nie może być w teoretycznego idealnego systemu gazowego. Utworzony w ten sposób komunikację nazwie chemicznej lub wartościowość. W przypadku, gdy rzeczywista gazu zjonizowane nich pojawiają się kulomb obiektów siły, które określają sposób, na przykład w osoczu, który jest quasi-obojętne związki jonowe. Jest to szczególnie istotne w świetle faktu, że fizyka plazmy Dzisiaj jest ogromna, szybko rozwijające się dyscypliny naukowej, która ma bardzo szerokie zastosowanie w astrofizyce, teoria sygnałów radiowych oraz problem jądrowy kontrolowanych reakcji termojądrowych.

Wiązania chemiczne w rzeczywistych gazów przez ich charakter nie różnią się od sił molekularnych. Te i inne dużej mierze ograniczone do oddziaływania elektrycznego pomiędzy ładunkami atomów, z których wszystkie są wykonane atomowego oraz struktura cząsteczkowa substancji. Niemniej jednak całkowite zrozumienie molekularnych i chemicznych sił jest możliwe tylko z powstawaniem mechaniki kwantowej.
Musimy przyznać, że nie każdy stan materii, który jest zgodny z równaniem holenderskiego fizyka, mogą być realizowane w praktyce. Wymaga to również czynnik ich stabilności termodynamicznej. Jednym z ważnych czynników takich warunków stabilności jest to, że w równaniu ciśnienia izotermicznej musi być ściśle przestrzegana w celu zmniejszenia skłonności do całego ciała. Innymi słowy, wraz ze wzrostem wartości V wszystkie izotermy prawdziwego gazu powinny spadać stopniowo. Tymczasem wykresu izotermy Van der Waalsa poniżej krytycznego poziomu temperatur rosnących części zostały spełnione. Punkty w tych strefach odpowiadają niestabilnym stanem substancji, które w praktyce nie może być zrealizowana.