Wszyscy słyszeliśmy enzymów, ale jest mało prawdopodobne, że każdy z nas doskonale wie, w jaki sposób substancje te są rozmieszczone, i dlaczego są one potrzebne. Ten artykuł pomoc w zrozumieniu struktury i funkcji enzymów (enzymów), w ogóle, a ich centrów aktywnych w szczególności.
badania Historia
W 1833 roku, francuski chemik Anselme Payen określić i opisać właściwości amylazy.
Kilka lat później, Louis Pasteur, studiując przemianę cukrów w alkohol z udziałem drożdży, zasugerował, że proces ten jest ze względu na chemikalia, które składają się na drożdże.
Pod koniec XIX wieku fizjologa Villi Kyune pierwszy ukuł termin „enzym”.
Niemiecki Eduard Buchnera 1897 zidentyfikowane i opisane zymaza – kompleksu enzymów, które katalizują przekształcenie sacharozy w reakcję etanolu. W naturze zymaza w wielkiej ilości w drożdżach.
Nie wiadomo, kiedy i kto otworzył miejsca aktywnego enzymu. To odkrycie przypisuje się laureat Nobla chemik Edaurdu Buchner, amerykański biolog James Sumner i innych znanych naukowców, którzy pracowali na badaniu katalizy enzymatycznej.

Ogólne informacje na temat enzymów
Przypomnijmy, że enzymy – substancje o charakterze białka, które pełnią funkcję w organizmach żywych katalizatory reakcji chemicznych. Enzym ma części, które nie są bezpośrednio uczestniczą w nim przepływ reakcji stanowi centrum aktywnego enzymu.
Oto niektóre z właściwości enzymów:
1) Efektywność. Niewielka ilość katalizatora wystarczającą aby przyspieszyć reakcję chemiczną w 10 6 razy.

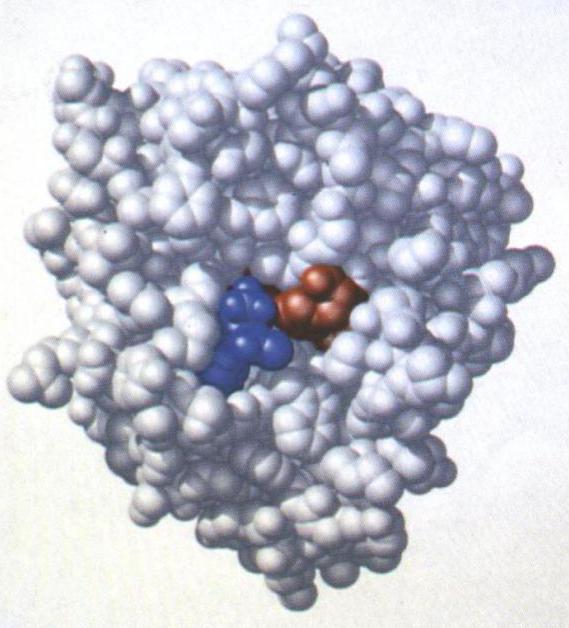
2) swoistości. Jeden enzym nie jest uniwersalny katalizator jakiejkolwiek reakcji w komórce. Dla enzymu wyrażone swoistość działania: każda enzym katalizuje jeden lub kilka podobnych reakcji z substratami (na stronie substratów), ale inne odczynniki chemiczne do tego samego rodzaju, enzym może być niepotrzebny. Interakcje z odpowiednimi podłożami i dalszego przyspieszenia reakcji stanowi centrum aktywnego enzymu.
3) Aktywność deszcz. Aktywność enzymu w komórce jest stale zmieniających się od niskiego do wysokiego.
4) stężenie pewnych enzymów w komórce nie jest stały i może się zmieniać w zależności od warunków zewnętrznych. Takie enzymy biologii nazywane indukowany.
Klasyfikacja enzymów
W swojej strukturze, enzymy mogą być podzielone na proste i złożone. Proste składają się wyłącznie z reszt aminokwasowych, są złożone grupy niebiałkowy substancji. Złożone zwane koenzymy.
Od typu enzymu katalizowanej reakcji są podzielone na:
1) Oksydoreduktazy (katalizowania reakcji redoks).
2) transferazy (przeniesiono do oddzielnych grup atomów).
3) liazy (rozszczepiają wiązania chemiczne).
4) Lipaza (postać połączenia w reakcji na skutek energii ATP).
5) izomerazy (uchuvstvuyut reakcji inwersji izomerów).
6) Hydrolazy (katalizowania reakcji chemicznej przez trawienie wiązań).
enzym struktura
Enzym – złożoną strukturę trójwymiarową, która składa się głównie z reszt aminokwasowych. Również nie jest grupą prostetyczną – składnik niebiałkowego charakter, związany z reszt aminokwasowych.
Enzymy – głównie globularne białka, które mogą być łączone w złożonych systemów. Podobnie jak inne substancje białkowe, enzymy denaturuje poprzez zwiększanie temperatury lub przez wystawienie na działanie pewnych substancji chemicznych. Podczas denaturacji enzymu zmienia strukturę trzeciorzędową i co za tym idzie właściwości centrum aktywnego enzymu. W rezultacie, aktywność enzymatyczna spada dramatycznie.
Katalizowanej Podłoże jest zwykle znacznie mniejszy niż sam enzym. Najprostszym enzym składa się z sześćdziesięciu reszt aminokwasowych, a jego aktywnym centrum – tylko dwa.
Są to enzymy katalitycznym, aminokwasy, które nie są przedstawione i organiczną grupę prostetyczną lub (częściej) nieorganiczne źródło – kofaktor.
Koncepcja miejscu aktywnym
Tylko niewielka część enzymu bezpośrednio udział w reakcjach chemicznych. Ta część enzymu o nazwie aktywnego. Miejsce aktywne enzymu – lipidów kilka reszt aminokwasowych lub grupy prostetyczne, który wiąże się z podłożem i katalizuje reakcję. Reszty aminokwasowe w miejscu aktywnym, mogą należeć do wszystkich aminokwasów – polarne, niepolarne, naładowany, aromatyczne nienaładowane.
Centrum aktywnego enzymu (co lipidów, aminokwasów i innych substancji zdolnych do reakcji z odczynnikami) – najważniejszą częścią enzymu bez tych substancji byłoby bezużyteczne.
Zazwyczaj cząsteczka enzym posiada tylko jedno miejsce aktywne, wiązanie z jednym lub więcej podobnych reagentów. Do reszt aminokwasowych w centrum aktywnym wodorem, tworzą wiązania hydrofobowe lub kowalencyjnych, z utworzeniem kompleksu enzym-substrat.
Struktura centrum aktywnego
Miejsce aktywne enzymów, proste i złożone jest kieszeń lub szczelina. Taka struktura centrum aktywnego enzymu musi spełniać geometrycznie i elektrostatycznie podłoże, ponieważ zmiany w strukturze trzeciorzędowej enzym może zmieniać miejsca aktywne.
Centrum katalityczne i wiążące – obszary centrum aktywnego enzymu. Oczywiste jest, że miejsce wiążące „Kontrola” zgodność substrat i wiąże się z nim, a środek katalityczny jest bezpośrednio zaangażowany w reakcji.
Wiązanie aktywnego środka podłoża
W celu wyjaśnienia, w jaki sposób miejsce aktywne enzymu związanego z danym odczynnikiem, kilka teorii, które zostały zaproponowane. Najbardziej popularne z nich – Teoria Fishera, to jest teoria „kluczem”. Fisher wynika, że nie jest enzymem, idealnie nadają się do każdego podłoża pod względem właściwości fizycznych i chemicznych. Po utworzeniu się jakichkolwiek modyfikacji nie występuje kompleks enzym-substrat.
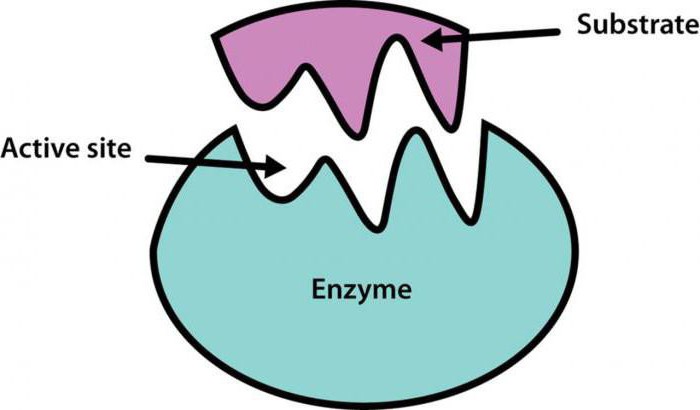
Inny amerykański uczony – Daniel Koshland – dodał Fisher założenie teorii, że miejsce aktywne enzymu może zmienić ich konformacji tak długo, jak nie pasuje do danego podłoża.
Kinetyka reakcji enzymatycznych
Reakcja funkcje enzymatyczne studiuje biochemii sektor prywatny – kinetyki enzymów. Ten szczególny badania naukowe dotyczące reakcji z różnych stężeń enzymów i substratów, na zależność szybkości reakcji od temperatury wewnątrz komórki i właściwości miejscu aktywnym enzymów w zależności od parametrów fizycznych i chemicznych właściwości nośnika.
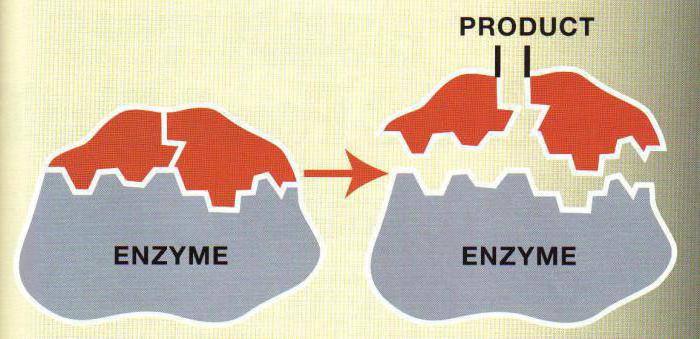
Kinetyki enzymów działa pojęć takich jak szybkość reakcji, energia aktywacji, barierę aktywacji, aktywności molekularnej, aktywności i innych. Rozważyć niektóre z tych pojęć.
To była odpowiedź biologiczną, odczynniki niezbędne do przeniesienia pewną energię. Energia ta nazywana jest energia aktywacji.
Dodawanie enzymu do składników reakcji, aby zmniejszyć energię aktywacji. Niektóre substancje reagują się bez udziału enzymów, ponieważ energia aktywacji jest zbyt wysoka. Równowaga reakcji nie jest przesunięty z dodatkiem enzymu.
Szybkość reakcji – ilość produktu reakcji pojawiła się lub zniknęła w jednostce czasu.
Zależność szybkości reakcji od stężenia substratu bezwymiarowa fizycznej charakteryzuje – stała Michaelisa.
Aktywność cząsteczkowy – liczba cząsteczek substratu, który przekształca się w jedną cząsteczkę enzymu na jednostkę czasu.








