W celu określenia składu jakościowego wielu produktach stosowanych ksantoproteinovaya reakcji z białkiem. Obecność aromatycznych aminokwasów w mieszaninie będzie zmieniać się w pozytywnej próbki badanej koloru.
Co to jest białko
Nazywana jest również białka, które jest budulcem dla organizmu żywego. Białka utrzymania masy mięśniowej, przywracanie rannych i martwych struktur tkankowych z różnych narządów, czy to włosy, skórę i więzadeł. Z ich udziałem, produkuje czerwonych krwinek, reguluje normalnego działania wielu hormonów i komórek układu odpornościowego. 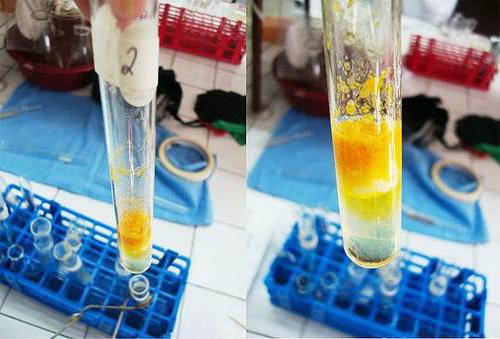
Jest to złożona cząsteczka jest to polipeptyd o masie większej niż 6 ~ 3 10 daltonów. Struktura białka tworzące reszt aminokwasowych w dużej ilości w połączeniu wiązanie peptydowe.
Struktura białka
Cechą tych związków w porównaniu do peptydów o niskiej masie cząsteczkowej, który rozwinął się trójwymiarową strukturę przestrzenną, wspierane wpływu na różnym przyciągania. Białka posiadają cztery strukturą. Dla każdego z nich ma swoje własne cechy.
Jako podstawę podstawowej organizacji cząsteczek pochodną sekwencję aminokwasów, struktury, która rozpoznaje ksantoproteinovaya reakcji z białkiem. Struktura ta jest cyklicznie powtarzających się wiązań peptydowych -HN-CH-CO-, selektywny rodniki części są łańcuchy boczne aminokwasów. definiują dalsze właściwości substancji jako całości.
Podstawową strukturą białka jest za wystarczająco silne, to ze względu na obecność silnych oddziaływań kowalencyjnych w wiązań peptydowych. Tworzenie kolejnych poziomach następuje w zależności od cech określonych w pierwszym etapie.
Tworzenie struktury drugorzędowej jest możliwe ze względu na skręcanie sekwencji aminokwasowej w spirali, w której wiązania wodorowe są ustanowione pomiędzy zwojami.
Organizacja poziomie wyższym cząsteczek utworzona jest przez zastosowanie jednej spirali na inne fragmenty z występowaniem wszystkich możliwych połączeń między nimi, wodorem, disulfid kowalencyjne lub związek jonowy. Rezultatem jest stowarzyszeniem w postaci kuleczek. 
Układ przestrzenny trzeciorzędowych struktur z tworzenia wiązań chemicznych między nimi prowadzi do tworzenia ostatecznej postaci cząsteczki lub poziomu czwartorzędowych.
aminokwasy
Powodują one chemiczne właściwości białek. Istnieje około 20 głównych aminokwasów tworzące polipeptydów w innej kolejności. Odnosi się to także rzadkie kwasu aminokarboksylowego w postaci hydroksyproliny i hydroksylizyny peptyd pochodzący od podstawy.
Jako przejaw reakcji białko rozpoznające ksantoproteinovaya obecność pewnych aminokwasów zapewnia zmianę koloru reagentów, co wskazuje na obecność określonych strukturach, w ich skład.
Jak się okazało, są kwasy karboksylowe, które miały miejsce podstawienie atomu wodoru w grupie aminowej.
Przykładem struktury cząsteczki może stanowić wzór strukturalny glicyny (HNH- HCH- COOH) jak najprostszy aminokwas. 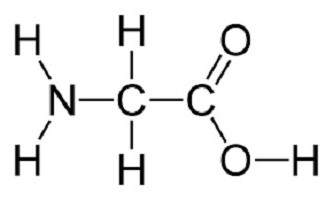
W tym przypadku, jeden z atomów wodoru CH2 – może być zastąpiony przez węgiel już grupę obejmującą pierścień benzenowy, aminowej, sulfo, karboksylowej.
Co reakcję ksantoproteinovaya
Do analizy jakościowej białek z zastosowaniem różnych technik. Należą do nich reakcje:
- biuretu z pojawieniem fioletowym kolorze;
- ninhydryną z wytworzeniem roztworu niebiesko-fioletowy;
- formaldehydu z utworzeniem czerwonym kolorze;
- Nogier celu wytrącenia szaro-czarne.
Wykonując każda metoda okazała się obecność białka oraz obecności pewnych grup funkcyjnych w cząsteczce.
Nie ksantoproteinovaya reakcji z białkiem. Nazywana jest również podział Mulder. Odnosi się to do niepożądanych kolorowych do białka, na które nie są aromatyczne i heterocykliczne aminokwasów.
Cechą tego sposobu jest przykładowy nitrowania kwas azotowy reszt cyklicznych aminokwasów w szczególności akcesyjne grupy nitrowej w pierścieniu benzenowym.
Wynikiem tego procesu jest tworzenie się związków nitrowych, który wytrąca się. Jest to podstawowa cecha ksantoproteinovaya reakcja.
Co określony aminokwas
Nie można wykryć wszystkie kwasu aminokarboksylowego pomocą takiej próbki. Główną cechą reakcji wykrywania białka ksantoproteinovaya – obecność pierścieniem benzenu lub pierścieniem heterocyklicznym w cząsteczce aminokwasów.
Ponieważ białko izoluje się z kwasów aminokarboksylowych dwóch pierścieni aromatycznych, w których występuje grupa fenylo (dla fenyloalaniny) i rodników hydroksy (tyrozyny). 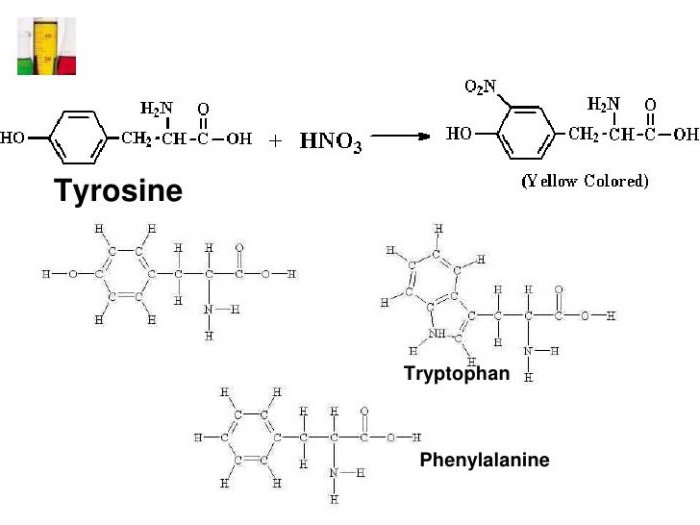
Reakcją ksantoproteinovaya ustala heterocykloamino tryptofanu, kwasu indolo posiadającą pierścień aromatyczny. Obecność powyższych związków białka daje charakterystyczną zmianę barwy w środowisku testowym.
Co użycie odczynników
W celu przeprowadzenia reakcji ksantoproteinovaya konieczne przygotowanie 1% roztworu białka jaj, lub pochodzenia roślinnego.
Zwykle stosuje się jaja, który jest podzielony w celu dalszego oddzielenia białka z jaja. Dla 1% roztworu białka rozcieńczono w dziesięciokrotnej ilości oczyszczonej wody. Po rozpuszczeniu otrzymanego płynu białka powinien być filtrowane przez kilka warstw gazy. Roztwór ten powinien być przechowywany w chłodnym miejscu.
Jest możliwe, aby przeprowadzić reakcję z białkiem roślinnym. W celu przygotowania roztworu stosuje się mąkę pszenną w ilości 0,04 kg. 0,16 litra wody oczyszczonej. Składniki miesza się w naczyniu, które jest związane przez 24 godzin w chłodnym miejscu w temperaturze około + 1 ° C Na koniec dnia, roztwór miesza się, a następnie ich filtrowanie pierwszej watą a następnie – filtr papierowy składany. Otrzymaną ciecz przechowywano w chłodnym miejscu. Roztwór ten występuje głównie we frakcji białka.
W celu przeprowadzenia reakcji ksantoproteinovaya jako główny odczynnik stosowany stężonego kwasu azotowego. Dalsze reagenty to 10% roztwór wodorotlenku sodu lub amoniaku w roztworze żelatyny i niezagęszczony fenolu.
Metodologia
W czystej probówki jest 1% roztworu białka jaj lub -tym mąkę w ilości 2 ml. Do tego dodano około 9 kropli stężonego kwasu azotowego do flokulacji zatrzymany. Otrzymaną mieszaninę ogrzewa się, otrzymany żółty osad stopniowo znika, a jego barwa przechodzi do roztworu. 
Gdy ciecz ochładza się w rurce wzdłuż ściany dodano około 9 kropel wodorotlenku sodu, zatęża, co jest nadmiar do procesu. Środowisko reakcji staje się alkaliczna. Zawartość się pomarańczowego koloru w probówce.
Charakterystyka
Od ksantoproteinovaya zwanej reakcji jakościowy do kwasu azotowego w wyniku działania białek, próbka jest wykonywane pod zawarte wyciągiem. podczas pracy z skoncentrowanych substancji żrących przestrzegać wszystkich zasad bezpieczeństwa.
Uwolnienie zawartości z rurki mogą wystąpić w czasie procesu ogrzewania, które należy uwzględnić przy ustalaniu się w uchwycie i wybranie nachylenia.
Wybieranie stężonego kwasu azotowego i sody kaustycznej może jedynie za pomocą pipety szklane i gruszki gumy zabronione pipety doustnie.
reakcja względna fenolem
Dla jasności, procesu i potwierdzenie obecności grup fenylowych jest przeprowadzane w podobny próbki hydroksybenzen.
Rura wytwarzania 2 ml rozcieńczonego roztworu fenolu, a następnie stopniowo wzdłuż ściany, dodano 2 ml stężonego kwasu azotowego. Roztwór poddaje się ogrzewaniu, przy czym staje się żółty. Reakcja ta jest jakość obecności pierścienia benzenowego. 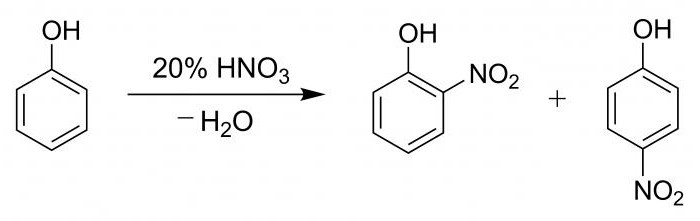
hydroksybenzen proces nitrowany kwasem azotowym, a następnie przez utworzenie mieszaniny p-nitrofenolu i o-nitrofenolu w wysokości 15 do 35 lat.
test porównawczy z żelatyny
W celu wykazania, że reakcja ksantoproteinovaya białka ujawnia aminokwas aromatyczny, stosowanie białek, które nie mają grupę fenolową.
W czystej probówki jest 1% roztwór żelatyny w ilości 2 ml. Do tego dodano około 9 kropli stężonego kwasu azotowego. Otrzymaną mieszaninę ogrzewa się. Rozwiązanie nie jest w kolorze żółtym, co świadczy o braku aminokwasów z aromatyczną strukturą. Czasami istnieje niewielkie zażółcenie środowiska ze względu na obecność zanieczyszczeń białkowych.
równania chemiczne
W dwuetapową reakcję prowadzi ksantoproteinovaya białek. Wzór pierwszy etap procesu nitrowania opisano cząsteczek aminokwasów z użyciem stężonego kwasu azotowego.
Przykładem jest przyłączenie grupy nitrowej do tyrozyny dla utworzenia nitrotyrozyna i dinitrotirozina. W pierwszym przypadku na pierścień benzenowy jest przyłączony jeden -radical NO: 2, a drugi związek ma dwa atomy wodoru są zastąpione przez NO2. Wzór chemiczny ksantoproteinovaya tyrozynowej reakcja reprezentowana przez reakcję z kwasem azotowym w celu utworzenia cząsteczki nitrotyrozyna.
proces nitrowania towarzyszy przejście w postaci bezbarwnego zabarwienia żółtego odcienia. Podczas przeprowadzania tej reakcji z białka zawierające reszty aminokwasów fenyloalanina lub tryptofan i zmiany barwy roztworu.
W drugim etapie produkt reakcji nitrowania tyrozyny, szczególnie cząsteczek nitrotyrozyna, z amoniakiem lub wodorotlenek sodu. Wynikiem jest solą sodu lub amonu, w którym żółto-pomarańczowy kolor. Taka reakcja jest związane z możliwością cząsteczek nitrotyrozyna poruszać się w postaci quinoid. Następnie sól powstała z niej kwas Nitronic, który posiada system chinonu sprzężonych wiązań podwójnych. 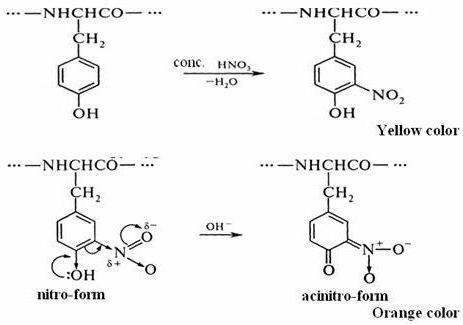
W ten sposób kończy się reakcję ksantoproteinovaya białek. Równanie przedstawione powyżej drugiego etapu.
wyniki
Podczas analizy płynów zawartych w trzech rur, roztworu odniesienia rozcieńczono fenolu. Substancje z pierścieniem benzenu dają reakcję jakościowy z kwasem azotowym. W efekcie zmienia kolor roztworu.
Jak to jest znane, składa się z hydrolizowanej żelatyny postaci kolagenu. Białko nie zawiera aromatyczną strukturę aminokwasów. Brak zmiany barwy środowiska w reakcji z kwasem.
W trzeciej probówce jest dodatnią reakcję na białko ksantoproteinovaya. Można wnioskować, w następujący sposób: wszystkie białka z aromatycznych struktura, czy to fenyl lub pierścień indolowy, biorąc pod uwagę zmiany barwy roztworu. Wynika to z utworzeniem związków nitrowych o kolorze żółtym.
Przeprowadzenie reakcji barwnej dowodzi obecność różnych strukturach chemicznych w aminokwasy i białka. Przykład żelatyna wykazuje, że jej skład obejmuje kwas aminokarboksylowy nie posiadającego grupę fenylową lub struktury cykliczne.
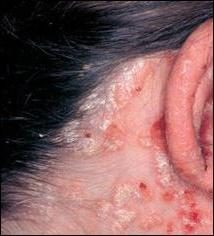
Z ksantoproteinovaya reakcji może być wyjaśnione przez żółknięcie skóry po nałożeniu na niego mocnego kwasu azotowego. Ten sam kolor będzie pieniste mleko podczas jej podobnej analizy.
W klinicznym laboratorium ta próbka koloru nie jest wykorzystywany do wykrywania białka w moczu. Wynika to z koloru żółtego samego moczu.
Reakcję Ksantoproteinovaya stał się coraz częściej stosowane do oznaczania ilościowego aminokwasy takie jak tryptofan i tyrozynę, w ramach różnych białek.