Jak wiadomo, białka – podstawą powstania życia na naszej planecie. Według teorii Oparin-Haldane był koacerwatu kropla, składający się z cząsteczek peptydów, stało się podstawą powstania istot żywych. Jest to bez wątpienia dlatego, że analiza struktury wewnętrznej każdego członka biomasy pokazuje, że substancje te mają wszystko: rośliny, zwierzęta, mikroorganizmy, grzyby, wirusy. I są one bardzo zróżnicowane w naturze i Makromolekularnych.
Nazwy tych czterech struktur, są synonimami:
- białka;
- białka;
- polipeptydy;
- peptydy.

cząsteczki białka
Ich liczba jest naprawdę nieobliczalne. W tym przypadku, wszystkie te cząsteczki mogą być podzielone na dwie główne grupy:
- Proste – składać się jedynie z sekwencji aminokwasowych połączonych wiązaniami peptydowymi,
- Complex – Konstrukcja i struktura białka, charakteryzują się dodatkowymi protolytic (protetyczne) grupy, nazywane również kofaktorów.
W tym przypadku złożone cząsteczki mają także swój klasyfikacji.
Stopniowanie złożone peptydy
- Glikoproteiny – są ze sobą ściśle powiązane białka i węglowodanów związków. Struktura cząsteczki włókniny grupy prostetyczne mukopolisacharydy.
- Lipoproteiny – związek kompleksowy z białek i lipidów.
- Metaloproteiny – jako grup prostetycznych są jony metali (żelazo, mangan, miedź i inne).
- – Odpowiedź nukleoproteiny białka i kwasy nukleinowe (DNA, RNA).
- Fosfoproteidy – konformacja białka i pozostałość kwasu fosforowego.
- Chromoproteids – bardzo podobne do metaloprotein, że element, który stanowi część grupy protetyczne barwnego kompleksu (czerwony – hemoglobina, zielony – chlorofil, i tak dalej).
Każda grupa omówiono strukturę i właściwości białka są różne. Funkcje, które wykonują, i będą się zmieniać w zależności od rodzaju cząsteczki.

Struktura chemiczna białek
Z tego punktu widzenia białek – długi masywną łańcucha reszt aminokwasów połączonych wzajemnie specyficzne wiązania zwane peptydów. Od strony kwasy konstrukcje odejść oddział – rodniki. Ta struktura cząsteczki została odkryta przez E. Fischer na początku XXI wieku.
Następnie białka, struktury i funkcji białek zbadano bardziej szczegółowo. Okazało się, że aminokwasy tworzące strukturę peptydową, w sumie 20, a tym samym mogą być łączone na różne sposoby. Stąd różnorodności struktur polipeptydów. Ponadto, w trakcie życia i wykonywania swoich funkcji białka mogą ulegać szereg chemicznych przekształceń. W rezultacie, zmieniają strukturę i nie ma zupełnie nowy typ połączenia.
Do zerwania wiązanie peptydowe, czyli zakłócić strukturę białka łańcuchów musi być wybrany bardzo surowych warunków (wysokie temperatury, katalizator kwasowy lub zasadowy). Jest to spowodowane wysoką wytrzymałość kowalencyjnych wiązań w cząsteczce, a mianowicie w grupie peptydów.

Wykrywanie struktury białka w laboratorium prowadzi się drogą reakcji biuretu – wpływ na polipeptyd świeżo strąconego wodorotlenku, miedzi (II). Kompleks z jonami grupy peptydów i miedzi zawiera jasny kolor fioletowy.
Istnieją cztery podstawowe organizacja strukturalna, z których każdy ma swoje własne cechy struktury białek.
Poziomy organizacji: pierwotna struktura
Jak wspomniano powyżej, peptyd – sekwencję reszt aminokwasowych z wtrąceniami, koenzymy, lub bez nich. Tak nazywają to podstawowa struktura cząsteczki, co jest naturalne, oczywiście, to jest prawdziwy aminokwasów połączonych wiązaniami peptydowymi, i nic innego. Oznacza to, że struktura polipeptydu liniowe. W tej konkretnej struktury białek tego typu, – że ta kombinacja kwasów ma zasadnicze znaczenie dla realizacji funkcji w cząsteczce białka. Dzięki tym cechom możliwe jest nie tylko zidentyfikować peptyd ale również do przewidywania właściwości i roli zupełnie nowe, jeszcze nieodkryte. Przykłady peptydów zawierających naturalny podstawowej struktury, – insulina, chymotrypsyny, pepsyny, a także inne.
wtórny konformacja
Struktura i własności białek w tej kategorii różnią się nieco. Taka struktura może być uformowana pierwotnie w naturze lub gdy podstawowym poddane hydrolizie sztywnej, temperatury i inne warunki.
To ukształtowanie ma trzy odmiany:
- Gładkie, regularne, stereoregularne cewki wykonany z reszt aminokwasowych, które są skręcone wokół osi połączenia lokalnego. Jedynie trzymane razem poprzez wiązania wodorowe występujących między grupą tlenu jednego peptydu i wodór. Przy czym struktura jest poprawne ze względu na fakt, że obroty równomiernie powtarzane co 4 poziomu. Taka struktura może być zarówno leworęczne i pravozakruchennoy. Jednak w większości znanych białek prawoskrętnych izomerów dominuje. Takie ukształtowanie jest zwany alfa struktury.
- Skład i struktura o następującej białko typu różni się od poprzedniego tym, że wiązania wodorowe, nie są utworzone pomiędzy stojących obok siebie na jednym boku z resztą cząsteczki i pomiędzy zasadniczo usunięta, przy czym przy wystarczająco dużej odległości. Z tego powodu, cała konstrukcja staje się faliste zwiniętych łańcuchy polipeptydowe węża. Jest jedna cecha, która powinna być białko. Struktura aminokwasów rozgałęzień powinny być tak krótkie, jak glicyna lub alanina, na przykład. Ten typ jest nazywany wtórnym konformacji beta-arkusze pod kątem ich zdolności do sklejania czy tworzenie ogólnej struktury.
- Należące do trzeciej struktury białka typu jak biologii oznacza kompleks raznorazbrosannye, nieuporządkowanych fragmenty nie posiadające stereoregularność i zdolne do modyfikowania struktury pod wpływem warunków zewnętrznych.
Przykłady białek mających strukturę drugorzędową z natury nie jest ujawnione.

szkolnictwo wyższe
Jest to dość skomplikowana budowa, o nazwie „kulka”. Co to jest białko? Struktura jest on oparty na konstrukcji wsporczej, ale dodano nowe typy oddziaływań pomiędzy atomami grup, a cała cząsteczka fałdy podobne, prowadzone w taki sposób, z tym, że grupy hydrofilowe, które są skierowane do kuleczek i hydrofobowe – out.
Wyjaśnia to ładunek cząsteczki białka w roztworach koloidalnych wody. Jakie są rodzaje oddziaływań są tam?
- Wiązania wodorowe – pozostaje niezmieniona od tych samych części, jak w strukturze drugorzędowej.
- Hydrofobowa (hydrofilowe) Interakcja – powstaje po rozpuszczeniu w wodzie polipeptydu.
- Jonowy przyciąganie – raznozaryazhennymi utworzony pomiędzy resztami aminokwasów (rodnika) grup.
- Oddziaływania kowalencyjne – może być utworzony pomiędzy specyficznych miejsc kwasowych – cysteiny cząsteczek, lub raczej ich ogonów.
Tak więc, kompozycja i struktura białka, które mają struktury trzeciorzędowej, mogą być opisane jako zwinięta w łańcuchach polipeptydowych kulki, zachowując swoje ukształtowanie i stabilizacji ze względu na różne typy oddziaływań chemicznych. Przykłady takich peptydów: fosfoglitseratkenaza, tRNA, alfa-keratyny, jedwabiu fibroina i inne.
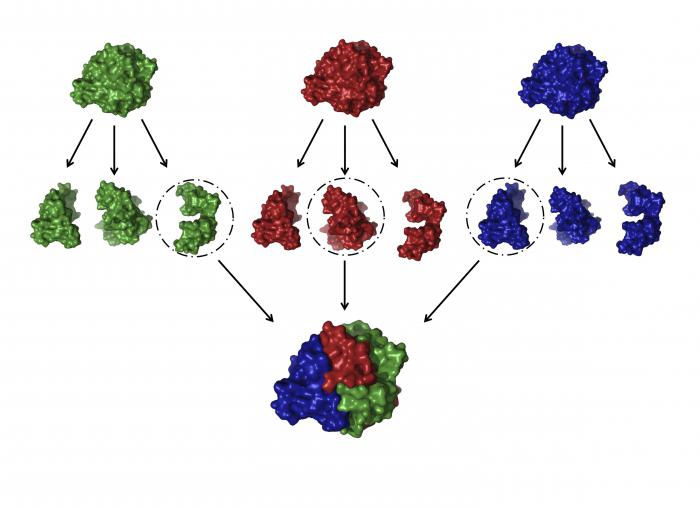
Czwartorzędowy struktura
Jest to jeden z najtrudniejszych globulek, stanowiących białka. Struktura i funkcja białek takiego programu jest bardzo uniwersalne i specyficzne.
Co to jest konformacja? Jest kilka (niekiedy dziesiątki) dużych i małych łańcuchów polipeptydowych, które są tworzone niezależnie od siebie. Ale potem, z powodu tych samych interakcji, które są uważane za nas struktury trzeciorzędowej tych peptydów są skręcone i ze sobą powiązane. Otrzymany w ten sposób złożone konformacyjne kuleczek, które mogą zawierać atomy metali i grup lipidów i węglowodanów. Przykłady takich białek: polimerazy DNA, białka otoczki wirusa, tytoń, hemoglobiny i innych.

Wszystkie struktury peptydów Omówiliśmy mają własne metody identyfikacji w laboratorium, na podstawie aktualnych możliwości wykorzystania chromatografii, wirowania, elektron i mikroskopii optycznej i wysokich technologii komputerowych.
funkcje
Struktura i funkcja białek jest ściśle skorelowane ze sobą. Oznacza to, że każdy peptyd odgrywa rolę, która jest unikalna i specyficzna. Są też tacy, którzy są w stanie wykonać w żywej komórce, kilka znaczących transakcji. Ale można go streścić wyrazić podstawowe funkcje cząsteczek białek w organizmach istot żywych:
- Zapewnienie ruchu. Cone organizmy lub organelli lub niektóre typy komórek są zdolne do przemieszczania się, skaleczenia, ruchów. Białko to jest, tworząc część jego struktury urządzenia silnikowego: rzęski, rzęski, cytoplazmatyczną. Jeśli mówimy o niemożliwości przemieszczenia komórek, białka mogą przyczyniać się do redukcji ich miozyny (mięśnie).
- Funkcja odżywcza lub kopii zapasowej. To nagromadzenie cząsteczek białkowych w oocytach, zarodki i nasiona roślin dla dalszego napełniania brakujących składników odżywczych. Po odcięciu peptydu wytwarzają aminokwasy oraz substancje biologicznie czynne, które są konieczne do prawidłowego rozwoju organizmów żywych.
- Funkcja energii. Oprócz węglowodanów zmusza organizm może wytwarzać i białek. W wyniku rozpadu 1 g peptydu uwolnionego 17,6 kJ energii użytecznej postać trifosforanu adenozyny (ATP), który przeznacza się na żywotnych procesów.
- Sygnał i funkcja regulacyjna. Polega on na przeprowadzeniu starannego monitorowania zachodzących procesów i przekazywanie sygnałów z komórki do tkanki, z nich do władz, od najnowszych do systemu i tak dalej. Typowym przykładem jest insulina, która jest ściśle rejestruje liczbę glukozy we krwi.
- funkcja receptora. Osiąga się to przez zmianę konformacji peptydu, z jednej strony błony, a sprzęganie drugi koniec restrukturyzacji. Kiedy to nastąpi i transmisji sygnału i informacje wymagane. Większość z tych białek są wbudowane w błonie cytoplazmatycznej komórek i przeprowadzenie ścisłą kontrolę nad wszystkimi materiału przepływającego przez nią. Również ostrzegać do chemicznych i fizycznych zmian w środowisku.
- Funkcja Transport peptydów. Odbywa się to kanały białek i białek transporterów. Ich zadaniem jest oczywiste, – transportowania pożądanych cząsteczek do miejsc o niskim stężeniu wysokich elementów. Typowym przykładem jest transport tlenu i dwutlenku węgla z narządów i tkanek hemoglobiny białka. Mają również uzyskać dostarczanie związków o niskiej masie cząsteczkowej przez membranę do wnętrza komórki.
- Funkcja struktura. Jednym z najważniejszych z tych, które wykonuje białko. Struktura komórek i organelli, jest ich peptydy. Są one podobne do ramy określają kształt i strukturę. Ponadto, są one również wspierać je i modyfikować w razie potrzeby. Dlatego dla wzrostu i rozwoju wszystkich organizmów żywych podstawowych białek w diecie. Takie peptydy obejmują tubuliny elastynę, kolagen, aktyny i inne keratyny.
- Funkcja katalitycznego. Jej wykonywania enzymy. Liczne i zróżnicowane, przyspieszają wszystkie reakcje chemiczne i biochemiczne w organizmie. Bez ich udziału, zwykłe jabłko w żołądku będzie w stanie strawić tylko na dwa dni, to może zginać się w tym samym czasie. Pod wpływem działania katalazy, peroksydazy i innych enzymów, proces ten odbywa się w ciągu dwóch godzin. W ogóle, to dzięki tej roli anabolizmu białek i katabolizm jest przeprowadzana, czyli plastikowy i energetycznego metabolizmu.

Rolę ochronną
Istnieje kilka rodzajów zagrożeń, z których białka są zaprojektowane, aby chronić organizm.
Po pierwsze, działanie środków chemicznych urazów odczynniki, gazy, cząsteczki, substancje odmienne spektrum działania. Peptydy są w stanie połączyć się ze sobą w reakcję chemiczną konwersję w nieszkodliwej postaci lub po prostu neutralizowania.
Po drugie, zagrożenie fizyczne z rany – jeśli białko fibrynogen w czasie nie przekształca się fibryny w miejscu uszkodzenia, krew nie koagulacji, a tym samym nastąpi zablokowanie. Potem, wręcz przeciwnie, musi peptydowy plazmina zdolny zasysane skrzepu i przywrócenia drożności naczynia.
Po trzecie, groźba zwolnienia. Struktura i jakość białek, które tworzą układ odpornościowy, są niezwykle ważne. Przeciwciała, immunoglobuliny, interferony – to ważne i istotne elementy układu odpornościowego i limfatycznego. Wszelkie cząstki stałe, szkodliwe cząsteczki martwe komórki lub części całej konstrukcji jest poddana natychmiastowego dochodzenia do związku peptydowego. Dlatego człowiek może sam, bez pomocy leków codziennie, aby chronić się przed zakażeniem i prostych wirusów.
właściwości fizyczne
Struktura komórek białko jest bardzo specyficzna i zależy od funkcji. Ale właściwości fizyczne peptydów są podobne i może być zredukowana do następujących cech.
- Cząsteczki waga – do 1000000 Daltonów.
- W roztworze wodnym, tworząc układ koloidalny. Nie przejmuje konstrukcja ładować zdolny różnią się w zależności od kwasowości medium.
- Po wystawieniu na działanie surowych warunków (promieniowanie, kwasu lub zasady, temperatury, itd) są w stanie przenieść na inne poziomy konformacji, tj denaturację. Proces, w 90% przypadków nieodwracalne. Jednakże, istnieje odwrotna zmiana – renaturyzacja.
To podstawowe właściwości fizycznych właściwości peptydów.












