Ogólna formuła alkenów. Właściwości i właściwości alkenów
Najprostszymi związkami organicznymi są węglowodory o ograniczonej zawartości i nienasycone. Obejmują one substancje klas alkanów, alkynów, alkenów. 
Ich wzory obejmują atom wodoru i atomów węgla w pewnej sekwencji i ilości. Często znajdują się w naturze.
Definicja alkenów
Inną nazwą są olefiny lub węglowodory etylenowe. Jest to nazwa tej klasy związków w XVIII wieku, kiedy odkryto oleisty płyn, chlorek etylenu.
Alkeny obejmują substancje składające się z elementów wodoru i węgla. Należą do acyklicznych węglowodorów. W swojej cząsteczce istnieje pojedynczy podwójny (nienasycony) wiązanie łączące dwa atomy węgla ze sobą.
Wzory alkenów
Każda klasa związków ma swoje oznaczenie chemiczne. W nich symbole elementów układu okresowego wskazują skład i strukturę połączenia każdej substancji. 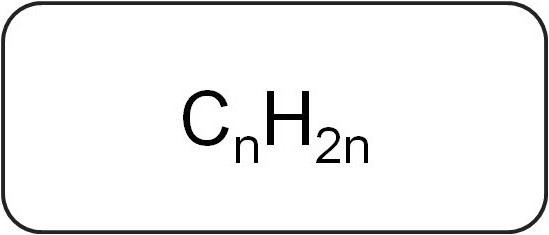
Ogólny wzór alkenów jest następujący: C n H 2 n , gdzie liczba n jest większa lub równa 2. Gdy jest ona odczytywana, jest jasne, że na atom węgla ma dwa atomy wodoru.
Wzory molekularne alkenów z serii homologicznych przedstawiają następujące struktury: C2H4, C3H6, C4H8, C5H10, C6H12, C7H14, C8H16, C9H18, C10H20. Można zauważyć, że każdy kolejny węglowodór zawiera więcej węgli i więcej wodoru.
Istnieje graficzna nazwa miejsca i kolejności związków chemicznych pomiędzy atomami w cząsteczce, co wskazuje wzór strukturalny alkenów. Przy pomocy wartościowości kreska wskazuje na połączenie węgli z wodorem.
Wzór strukturalny alkenenu można przedstawić w postaci rozszerzonej, gdy wyświetlane są wszystkie pierwiastki i wiązania chemiczne. Przy bardziej zwięzłej ekspresji olefin, wiązanie węgiel-wodór nie jest pokazane za pomocą wzorów wartościowości.
Wzór szkieletowy oznacza najprostszą strukturę. Linia przerywana stanowi podstawę cząsteczki, w której atomy węgla są reprezentowane przez jego końce i końce, a ogniwa oznaczają wodór.
Jak powstają nazwy olefin
Zgodnie z systematyczną nomenklaturą, alkenowe wzory i ich nazwy składają się z struktury alkanów należących do ostatecznych węglowodorów. W tym celu w imię ostatniego sufiksu-an zastępuje się -lenem lub -enem. Przykładem jest tworzenie butylenu z butanu i pentenu z pentanu.
Aby wskazać położenie podwójnego wiązania w odniesieniu do atomów węgla, pod koniec nazwy należy podać cyfrę arabską.
Nazwa alkenów opiera się na oznaczeniu węglowodoru o najdłuższym łańcuchu, w którym występuje podwójne wiązanie. Zwykle wybierany jest numer końcowy łańcucha, który jest najbliżej nienasyconego związku o atomach węgla.
Jeśli wzór strukturalny alkenów ma rozgałęzienia, wskaż nazwy rodników i ich liczbę, a przed nimi umieść numery odpowiadające miejscu w łańcuchu węglowym. Następnie następuje nazwa węglowodoru. Po numerze są zazwyczaj wprowadzone łącznik.
Są nienasycone gałęzie rodników. Ich nazwy mogą być trywialne lub ukształtowane zgodnie z zasadami nomenklatury systematycznie.
Na przykład HNS = CH- nazywa się etenyl lub winyl.
Izomery
Formuły molekularne alkenów nie mogą wskazywać na izomeryzm. Jednakże dla tej klasy substancji, z wyjątkiem cząsteczki etylenu, modyfikacja przestrzenna jest wrodzona. 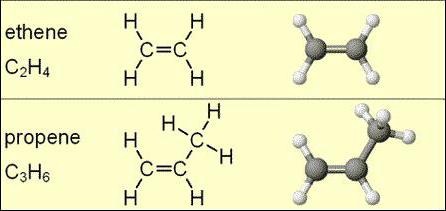
Izomery węglowodorów etylenowych mogą znajdować się wzdłuż szkieletu węglowego, pozycji nienasyconych więzi, interklasy lub przestrzennych.
Ogólny wzór alkenów określa liczbę atomów węgla i atomów wodoru w łańcuchu, ale nie pokazuje obecności i położenia wiązania podwójnego. Przykładem jest cyklopropan jako izomer międzygromowy C3H6 (propylen). Inne rodzaje izomeryzacji manifestują się w C4H8 lub butenie.
Różna pozycja nienasyconego wiązania jest obserwowana w butene-1 lub butenie-2, w pierwszym przypadku związek podwójny znajduje się w pobliżu pierwszego atomu węgla, aw drugim – w środku łańcucha. Izomeryzację szkieletu węglowego można rozpatrywać przykładem metylopropenu (CH3-C (CH3) = CH2) i izobutylenu ((CH3) 2C = CH2).
Modyfikacja przestrzenna jest związana z butenem-2 w pozycji trans i cis. W pierwszym przypadku rodniki boczne są usytuowane na górze i na dole głównego łańcucha węglowego z wiązaniem podwójnym, w drugim izomerze podstawniki znajdują się po tej samej stronie.
Charakterystyka olefin
Ogólna formuła alkenów określa stan fizyczny wszystkich przedstawicieli danej klasy. Począwszy od etylenu i kończąc na butylenie (od C 2 do C 4 ) substancje występują w postaci gazowej. Tak więc bezbarwny etylen ma słodki zapach, ma małą rozpuszczalność w wodzie, masę cząsteczkową mniejszą niż w powietrzu.
W postaci ciekłej są przedstawione węglowodory o homologicznej szczelinie od C 5 do C 17 . Począwszy od alkenu o 18 atomach węgla w łańcuchu głównym, stan fizyczny zmienia się w postać stałą.
Wszystkie olefiny są uważane za złe w wodnych ośrodkach, ale dobrze w rozpuszczalnikach o charakterze organicznym, takich jak benzen lub benzyna. Ich masa cząsteczkowa jest mniejsza niż w wodzie. Wzrost łańcucha węglowego prowadzi do wzrostu charakterystyk temperatury podczas topienia i wrzenia tych związków.
Właściwości olefin
Wzór strukturalny alkenów wykazuje obecność w szkielecie wiązania podwójnego z związków π- i σ- dwóch atomów węgla. Ta struktura cząsteczki określa jego właściwości chemiczne. Wiązanie π jest uważane za nie bardzo silne, co pozwala na jego zniszczenie poprzez utworzenie dwóch nowych wiązań-σ, które są uzyskiwane w wyniku dodania pary atomów. Nienasyconymi węglowodorami są donory elektronów. Uczestniczą w procesach łączenia elektrofilii. 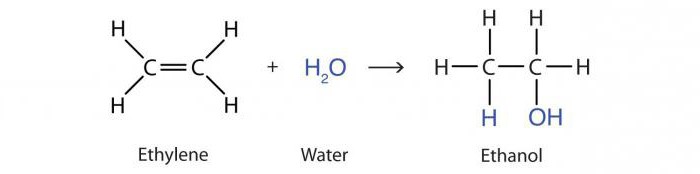
Ważną właściwością chemiczną wszystkich alkenów jest proces chlorowcowania, z wydzieleniem związków podobnych do pochodnych dihalogenowych. Atomy chlorowca mogą być przyłączone przez podwójne wiązanie z atomem węgla. Przykładem jest bromowanie propylenu z utworzeniem 1,2-dibromopropanu:
H 2 C = CH-CH3 + Br2 → BrCH2-CHBr-CH3.
Ten proces neutralizacji kolorowej w wodzie bromowej alkenami jest uważany za jakościowy dowód obecności podwójnego wiązania.
Ważnymi reakcjami są uwodornienie oligoli z dodatkiem cząsteczki wodoru w wyniku działania katalitycznych metali, takich jak platyna, pallad lub nikiel. W wyniku tego uzyskuje się węglowodory o nasyconym wiązaniu. Wzory alkanów, alkenów podano poniżej w reakcji uwodornienia butenu:
CH3-CH2-CH2CH2 + H2Ni → CH3-CH2-CH2-CH3.
Nazywany jest proces mocowania cząsteczki halogenku wodoru do olefin
Hydrohalogenowanie, przechodząc zgodnie z regułą odkrytą przez Markovnikov. Przykładem jest bromowodorowanie propylenu w celu utworzenia 2-bromopropanu. W nim wodór łączy się z podwójnym wiązaniem z węglem, który uważa się za najbardziej uwodorniony:
CH3-CH = CH2 + HBr → CH3-BrCh-CH3.
Reakcja alkenowego dodawania wody pod wpływem kwasów nazywa się hydratacją. W rezultacie uzyskuje się cząsteczkę alkoholu propanol-2 :
CH3-HC = CH2 + H20 → CH3 -OHCH-CH3.
Po ekspozycji na alkeny z kwasem siarkowym następuje proces sulfonowania:
CH3-HC = CH2 + HO-OSO-OH → CH3-CH3CH-O-SO2-OH.
Reakcja przebiega w celu utworzenia estrów kwasowych, na przykład kwasu izopropylosulfurowego.
Alkeny są podatne na utlenianie podczas ich spalania z działaniem tlenu z tworzeniem wody i gazem dwutlenku węgla:
2CH3-HC = CH2 + 9O2 → 6CO2 + 6H20.
Interakcja związków olefinowych i rozcieńczonego nadmanganianu potasu w postaci roztworu prowadzi do powstania glikoli lub diolei struktury dwuatomowej. Ta reakcja jest również utleniająca z tworzeniem glikolu etylenowego i odbarwieniem roztworu:
3H 2C = CH2 + 4H2O + 2KMnO4 → 3OHCH-CHOH + 2MnO2 + 2KOH.
Cząsteczki Alken mogą być zaangażowane w proces polimeryzacji za pomocą mechanizmu wolnego rodnika lub kationowego anionu. W pierwszym przypadku pod wpływem nadtlenków uzyskuje się polimer typu polietylenowego.
Zgodnie z drugim mechanizmem katalizatory kationowe są kwasami, a substancjami anionowymi są substancje metaloorganiczne z izolacją stereoselektywnego polimeru.
Czym są alkany
Są też nazywane parafinami lub ograniczającymi acykliczne węglowodory. Mają liniową lub rozgałęzioną strukturę, która zawiera tylko nasycone proste wiązania. Wszyscy przedstawiciele homologicznych serii tej klasy mają ogólny wzór C n H 2 n + 2 . 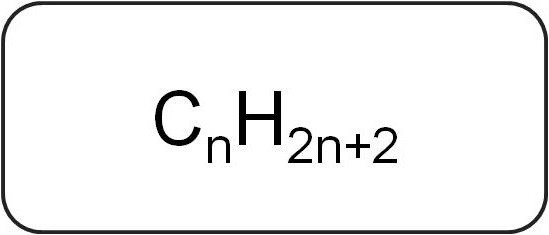
Zawierają one tylko atomy węgla i wodoru. Ogólny wzór alkenów powstaje z oznaczenia ostatecznych węglowodorów.
Nazwy alkanów i ich charakterystyki
Najprostszym przedstawicielem tej klasy jest metan. Są następujące substancje, takie jak etan, propan i butan. W sercu ich imienia jest korzeń cyfr w języku greckim, do którego dodaje się przyrostek-an. Nazwy alkanów są wymienione w nomenklaturze IUPAC.
Ogólny wzór alkenów, alkinów, alkanów obejmuje tylko dwa typy atomów. Obejmują one elementy węgla i wodoru. Liczba atomów węgla we wszystkich trzech klasach jest taka sama, różnica jest obserwowana tylko w ilości wodoru, którą można rozdzielić lub przyłączyć. Nasycone węglowodory dają nienasycone związki. Parafiny w cząsteczce zawierają więcej niż 2 atomów wodoru niż olefiny, co potwierdza ogólny wzór alkanów, alkenów. Struktura alkenów jest uważana za nienasyconą z uwagi na obecność wiązania podwójnego.
Jeśli korelujemy liczbę atomów wodoru i atomów węgla w alkanach, to wartość będzie największa w porównaniu z innymi klasami węglowodorów.
Począwszy od metanu i kończąc się butanem (od C 1 do C 4 ) substancje istnieją w postaci gazowej.
Węglowodory o homologicznej szczelinie od C 5 do C 16 są reprezentowane w postaci ciekłej. Począwszy od alkanu mającego 17 atomów węgla w łańcuchu głównym, stan fizyczny zmienia się w postać stałą.
Charakteryzuje się izomerizmem wzdłuż szkieletu węglowego i optycznymi modyfikacjami cząsteczki. 
W parafinach przyjmuje się, że węzły węglowe są w pełni zajęte sąsiednim atomem węgla lub wodoru w celu utworzenia wiązania typu σ. Z chemicznego punktu widzenia wynika to z ich słabych właściwości, dlatego alkany nazywane są nasyconymi lub nasyconymi węglowodorami, pozbawione powinowactwa.
Poddaje się reakcji substytucji związanej z radykalnym chlorowcowaniem, siulfochlorowaniem lub nitrowaniem cząsteczki.
Parafiny ulegają utlenianiu, spalaniu lub rozkładowi w wysokich temperaturach. Pod akceleratorami reakcji, atomy wodoru są rozdzielane lub alkany są odwodorniane.
Czym są alkynowie
Są one nazywane także węglowodorami acetylenowymi, w których występuje wiązanie potrójne w łańcuchu węglowym. Strukturę alkynów opisano wzorem ogólnym C n H 2 n-2 . Pokazuje, że w przeciwieństwie do alkanów, węglowodory acetylenowe pozbawione są czterech atomów wodoru. Są one zastępowane przez potrójne wiązanie utworzone przez dwa połączenia π.
Ta struktura określa właściwości chemiczne tej klasy. Strukturalna formuła alkenów i alkynów wyraźnie wskazuje na nienasycenie ich cząsteczkami, a także obecność podwójnych wiązań (H 2 C꞊CH2) i potrójnych (HC1CH).
Nazwa alkynów i ich właściwości
Najprostszym przedstawicielem jest acetylen lub HClCH. Jest to również nazywany ethyne. Pochodzi z nazwy nasyconego węglowodoru, w którym przyrostek -an jest usuwany i -in jest dodawany. W nazwach długich alkynów liczba ta wskazuje położenie potrójnego wiązania.
Znając strukturę węglowodorów nasyconych i nienasyconych, można ustalić, w których litwie jest określony wzór ogólny alkynów: a) CnH2n; C) CnH2n + 2; C) CnH2n-2; D) CnH2n-6. Prawidłowa odpowiedź to trzecia opcja.
Począwszy od acetylenu i kończąc z butanem (od C 2 do C 4 ) substancje mają charakter gazowy. 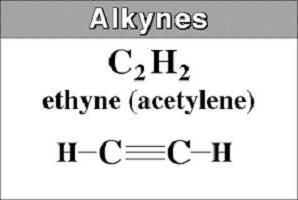
W postaci ciekłej występują węglowodory o homologicznej szczelinie od C 5 do C 17 . Począwszy od alkinu o 18 atomach węgla w łańcuchu głównym, stan fizyczny zmienia się w postać stałą.
Charakteryzuje się izomerizmem wzdłuż szkieletu węglowego, pozycją potrójnego wiązania, a także modyfikacjami między cząsteczkami cząsteczki.
Zgodnie z ich właściwościami chemicznymi, węglowodory acetylenowe są podobne do alkenów.
Jeśli alkinyl ma końcowe wiązanie potrójne, wówczas działają one jak kwas, tworząc sole alkynów, na przykład NaCtCNa. Obecność dwóch wiązań π powoduje, że cząsteczka acetylidynowa sodu silnego nukleofila wchodzi w reakcję substytucji.
Acetylen poddaje się chlorowaniu w obecności chlorku miedzi w celu otrzymania dichloroacetylenu, kondensacji pod wpływem chlorowcoalkinów z wyodrębnieniem cząsteczek diacetylenu.
Alkiny uczestniczą w elektrofilowych reakcjach addycyjnych, których podstawą jest chlorowcowanie, hydrochlorowcowanie, hydrorafinacja i karbonylowanie. Jednakże takie procesy są słabsze niż w alkenach z wiązaniem podwójnym.
W przypadku acetylenowych węglowodorów możliwe są reakcje addycyjne z nukleofilnym typem cząsteczki alkoholu, pierwszorzędowej aminy lub siarkowodoru.

















