Hel: właściwości, właściwości, zastosowanie
Hel jest gazem obojętnym 18-ej grupy periodycznego stołu. Jest to drugi najlżejszy element po wodorze. Hel jest gazem bez barwy, zapachu i smaku, który staje się ciekły w temperaturze -268,9 ° C. Temperatura wrzenia i temperatura krzepnięcia są niższe od temperatury wrzenia każdej innej znanej substancji. Jest to jedyny element, który nie ulega zestaleniu podczas chłodzenia przy normalnym ciśnieniu atmosferycznym. Jeśli hel przechodzi w stan stały, potrzeba 25 atmosfery w temperaturze 1 K.
Historia odkrycia
Hel został znaleziony w atmosferze gazowej otaczającej Słońce, francuski astronom Pierre Zhansen, który w 1868 roku podczas zaćmienia odkrył jasnożółtą linię w widmie chromosfery słonecznej. Początkowo przyjęto, że ta linia reprezentowała pierwiastek sodu. W tym samym roku angielski astronom Joseph Norman Lockyer obserwował żółtą linię w widmie słonecznym, które nie odpowiadało znanym linom sodowym D1 i D2, a więc nazywał to linią D3. Lockyer doszedł do wniosku, że został spowodowany substancją na Słońcu, nieznaną na Ziemi. On i chemik Edward Frankland w imię elementu użyli greckiej nazwy Słońca "helios".
W 1895 roku brytyjski chemik Sir William Ramsay dowiódł istnienia helu na Ziemi. Otrzymał próbkę uraniferous mineralnego klaveitu i po zbadaniu gazów powstałych podczas jego nagrzewania stwierdził, że jasnożółta linia w spektrum pokrywa się z linią D3 obserwowaną w widmie słonecznym. W ten sposób powstał nowy element. W 1903 r. Ramzi i Frederic Sodd stwierdzili, że hel jest produktem spontanicznego rozkładu substancji promieniotwórczych.

Dystrybucja w naturze
Masa helu wynosi około 23% całkowitej masy wszechświata, a element jest drugim najbardziej obfitym w kosmosie. Koncentruje się w gwiazdach, gdzie powstaje z wodoru w wyniku syntezy termojądrowej. Chociaż w atmosferze naziemnej hel jest w stężeniu 1 części na 200 tys. (5 ppm), a w małych ilościach znajduje się w minerałach promieniotwórczych, żelazach meteorytów, a także w źródłach mineralnych, duże ilości pierwiastków znajdują się w Stanach Zjednoczonych (zwłaszcza w Teksasie, Meksyk, Kansas, Oklahoma, Arizona i Utah) jako składnik (do 7,6%) gazu ziemnego. Małe rezerwy znaleziono w Australii, Algierii, Polsce, Katarze i Rosji. W skorupie ziemskiej koncentracja helu wynosi tylko około 8 części na miliard.
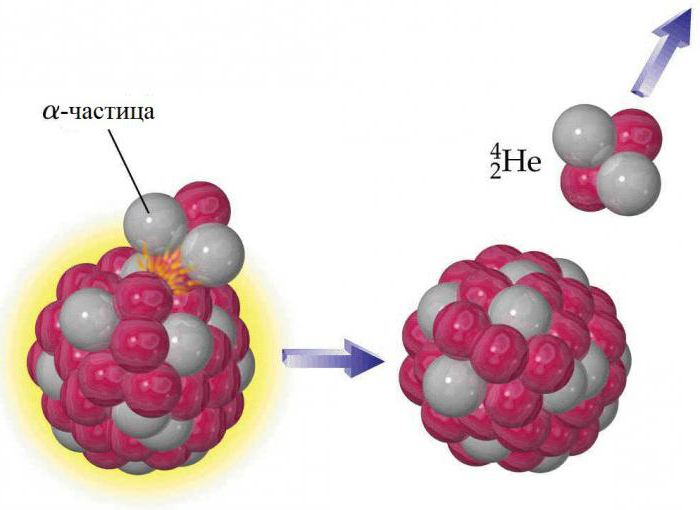
Izotopy
Jądro każdego atomu helu zawiera dwa protony, ale, podobnie jak inne pierwiastki, ma izotopy. Zawierają one od jednego do sześciu neutronów, więc ich masa wynosi od trzech do ośmiu. Trwały z nich to elementy, w których masę helu określa się liczbami atomowymi 3 ( 3 He) i 4 ( 4 He). Cała reszta jest radioaktywna i bardzo szybko rozkłada się na inne substancje. Ziemia hel nie jest pierwotnym składnikiem planety, powstała w wyniku rozpadu radioaktywnego. Cząstki alfa emitowane przez jądra ciężkich substancji promieniotwórczych są jądrami izotopu 4 He. Helium nie gromadzi się w dużych ilościach w atmosferze, ponieważ ziemska grawitacja nie wystarcza, aby zapobiec stopniowemu wyciekowi do kosmosu. Ślady 3 On na Ziemi wyjaśniono negatywnym rozkładem beta rzadkiego pierwiastka wodoru-3 (trytu). Jest najczęstszym izotopem stabilnym: stosunek liczby atomów od 4 He do 3 wynosi około 700 tysięcy do 1 w atmosferze i około 7 milionów do 1 w niektórych minerałach zawierających hel.
Własności fizyczne helu
Temperatura wrzenia i temperatura topnienia tego pierwiastka są najniższe. Z tego powodu hel występuje jako gaz, z wyjątkiem ekstremalnych warunków. Gazowy W wodzie rozpuszcza się mniej niż jakikolwiek inny gaz, a szybkość dyfuzji przez ciało stałe jest trzykrotnie większa niż w powietrzu. Jego współczynnik załamania jest najbliższy 1.
Przewodność cieplna helu jest druga tylko od przewodności cieplnej wodoru, a jej specyficzne ciepło jest wyjątkowo wysokie. W normalnych temperaturach podczas rozbudowy nagrzewa się, a poniżej 40 K chłodzi się. Dlatego przy T <40 K hel można przekształcić w ciecz przez ekspansję.
Element jest dielektryczny, jeśli nie jest w stanie zjonizowanym. Podobnie jak inne gazy szlachetne, hel ma metastabilne poziomy energii, które pozwalają pozostać zjonizowane w wyładowaniu elektrycznym, gdy napięcie pozostaje poniżej potencjału jonizacji.
Helium-4 jest unikalny, ponieważ ma dwie ciekłe kształty. Zwykły nazywany jest helem I i występuje w temperaturach od temperatury wrzenia 4,21 K (-268,9 ° C) do około 2,18 K (-271 ° C). Poniżej 2,18 K, przewodność cieplna 4 He staje się 1000 razy większa niż miedzi. Ten formularz nazywa się helem II, aby odróżnić go od zwykłych. Ma nadmiarowość: lepkość jest tak niska, że nie można jej zmierzyć. Helium II rozciąga się na cienkiej warstewce na powierzchni jakiejkolwiek substancji i ten film płynie bez tarcia, nawet w stosunku do grawitacji.
Mniej obfite helium-3 tworzy trzy różne fazy cieczy, z których dwa to płyny nadmiarowe. Superfluidity in 4 Odkryto go w połowie lat trzydziestych XX wieku, a to samo zjawisko w 3 Po raz pierwszy zauważył Douglas D. Osherov, David M. Lee i Robert S. Richardson z USA w 1972 roku.
Cieczowa mieszanina dwóch izotopów helu-3 i -4 w temperaturach poniżej 0,8 K (-272,4 ° C) dzieli się na dwie warstwy – praktycznie czystą 3 He i mieszaninę 4 He i 6% helu-3. Rozpuszczaniu się 3 He do 4 towarzyszy efekt chłodzący, który stosuje się przy projektowaniu kriostatów, w których temperatura helu spadnie poniżej 0,01 K (-273,14 ° C) i utrzymuje się przez kilka dni.

Połączenia
W normalnych warunkach hel jest chemicznie obojętny. W skrajnych przypadkach możliwe jest tworzenie połączeń elementów, które nie są stabilne w normalnych warunkach temperatury i ciśnienia. Na przykład hel może tworzyć związki z jodem, wolframem, fluorem, fosforem i siarką, gdy jest on wystawiony na działanie elektrycznego blasku jarzeniowego, gdy jest bombardowany elektronami lub w stanie plazmy. Tak więc, HeNe, HgHe 10 , WHe 2 i jonów molekularnych He 2+ , He 2+ , HeH + i HeD + . Technika ta umożliwiała także uzyskanie obojętnych cząsteczek He2 i HgHe.
Plazma
W Wszechświecie jądrowy hel jest przeważnie rozłożony, którego właściwości znacznie się różnią od cząsteczkowych. Elektrony i protony nie są połączone i mają bardzo dużą przewodność elektryczną nawet w częściowo zjonizowanym stanie. Naładowane cząstki silnie oddziałują na pole magnetyczne i elektryczne. Na przykład w wietrze słonecznym jony helu wraz z jonizowanym wodorem oddziałują z magnetosferą Ziemi, powodując północne światła.

Odkrycie złóż w USA
Po wierceniu studni w Dexter w Kansas w 1903 roku otrzymano nieomylny gaz. Początkowo nie było wiadomo, że zawiera hel. Jakiego rodzaju gaz został znaleziony przez geologa stanu Erasmus Haworth, który zebrał próbki i stwierdził, że na Uniwersytecie w Kansas z pomocą chemików Cady Hamilton i David McFarland stwierdził, że zawiera 72% azotu, 15% metanu, 1% wodoru i 12% nie zostało zidentyfikowane. Po dalszej analizie badacze stwierdzili, że 1,84% próbki to hel. Więc dowiedziałem się, że ten pierwiastek chemiczny jest obecny w ogromnych ilościach w jelitach Wielkich Równin, skąd można je wyekstrahować z gazu ziemnego.
Produkcja przemysłowa
To sprawiło, że Stany Zjednoczone były światowym liderem w produkcji helu. Zgodnie z sugestią Sir Richarda Trelfall, Marynarka USA sfinansowała trzy małe eksperymentalne rośliny, aby uzyskać tę substancję podczas pierwszej wojny światowej w celu dostarczenia balonu zaporowego lekkiego, niepalnego gazu podnoszącego. W tym programie wyprodukowano łącznie 5700 m 3 92%, chociaż wcześniej wyprodukowano mniej niż 100 litrów gazu. Część tego tomu została wykorzystana w pierwszym lotnisku helu amerykańskiego Marynarki Wojennej Stanów Zjednoczonych, C-7, która odbyła się 7 grudnia 1921 roku, pierwszy lot z Hampton Roads , Va , do Bolling Field w Waszyngtonie .
Chociaż proces niskiej temperatury skraplania w tamtym czasie nie był dostatecznie rozwinięty, aby znaczący był w okresie pierwszej wojny światowej, kontynuowano produkcję. Hel wykorzystywano głównie jako podnoszący się gaz w samolocie. Zapotrzebowanie na to wzrosło w czasie II wojny światowej, kiedy to zaczęło być stosowane do spawania łukowego. Element był także ważny w projekcie, aby utworzyć bombę atomową "Manhattan".

Rezerwat Narodowy USA
W 1925 r. Rząd Stanów Zjednoczonych utworzył krajowy rezerw helowy w Amarillo, w stanie Teksas, w czasie wojny podczas samolotów wojskowych i powietrznych. Wykorzystanie gazu po II wojnie światowej zmniejszyło się, ale w latach pięćdziesiątych masa wzrosła, aby zapewnić między innymi jego dostawę jako chłodziwo wykorzystywane do produkcji paliwa rakietowego na potrzeby tlenu i wodoru podczas wyścigu kosmicznego i zimnej wojny. Wykorzystanie helu w USA w 1965 roku było ośmiokrotnie wyższe niż szczytowe zużycie wojny.
Po przyjęciu ustawy w sprawie helu w 1960 r. Biuro górskie podpisało 5 prywatnych przedsiębiorstw w celu wydobycia pierwiastka z gazu ziemnego. W tym programie zbudowano gazociąg o długości 425 km, łączący te instalacje z rządem częściowo wyczerpanym w pobliżu Amarillo w stanie Texas. Mieszanina helu i azotu została pompowana do podziemnego składowania i pozostała tam, aż stało się konieczne.
Do roku 1995 zebrano zasoby jednego miliarda metrów sześciennych, a rezerwy narodowe wyniosło 1,4 mld USD, co spowodowało, że Kongres Stanów Zjednoczonych zakończy się w 1996 roku. Po przyjęciu w 1996 roku ustawy o prywatyzacji helu Ministerstwo Zasobów Naturalnych zaczęło likwidować depozytariusz w 2005 roku.

Czystość i wielkość produkcji
Hel, wyprodukowany przed rokiem 1945, miał czystość około 98%, pozostałe 2% stanowiły azot, co było wystarczające dla statków powietrznych. W 1945 roku powstała niewielka ilość 99,9-procentowego gazu do spawania łukowego. Do 1949 roku czystość powstałego elementu osiągnęła 99,995%.
Przez lata Stany Zjednoczone produkowały ponad 90% światowego helu handlowego. Od 2004 r. Produkuje ona 140 milionów m 3 rocznie, z czego 85% to w Stanach Zjednoczonych, 10% w Algierii, a reszta w Rosji i Polsce. Głównymi źródłami helu na świecie są pola gazowe w stanie Teksas, Oklahoma i Kansas.
Proces uzyskiwania
Hel (czystość 98,2%) izoluje się z gazu ziemnego poprzez upłynnianie innych składników w niskich temperaturach i przy wysokich ciśnieniach. Adsorpcja innych gazów przez schłodzony węgiel aktywny pozwala uzyskać czystość 99,995%. Niewielka objętość helu jest wytwarzana podczas skraplania powietrza na dużą skalę. Z 900 ton powietrza można uzyskać około 3,17 m3. M gazu.

Aplikacje
Noble Gas znalazł zastosowanie w różnych dziedzinach.
- Hel, posiadający właściwości umożliwiające uzyskanie bardzo niskich temperatur, jest używany jako czynnik chłodzący w Large Hadron Collider, nadprzewodzących magnesach urządzeń MRI i spektrometrach magnetycznego rezonansu jądrowego, urządzeniach satelitarnych, a także do skraplania tlenu i wodoru w pociskach Apollo.
- Jako gaz obojętny do spawania aluminium i innych metali, w produkcji włókien optycznych i półprzewodników.
- Aby wytworzyć ciśnienie w zbiornikach paliwa silników rakietowych, zwłaszcza tych, które pracują na ciekłym wodorze, ponieważ tylko gaz helowy zachowuje swój stan agregatu, gdy wodór pozostaje płynny);
- Lasery gazowe He-Ne służą do skanowania kodów kreskowych w kasie w supermarketach.
- Mikroskop helowo-jonowy pozwala uzyskać lepsze obrazy niż elektroniczne.
- Ze względu na wysoką przepuszczalność gaz szlachetny służy do sprawdzania szczelności, na przykład w systemach klimatyzacji samochodowej, a także do szybkiego napełniania poduszek powietrznych w zderzeniu.
- Niska gęstość umożliwia napełnianie kulami dekoracyjnymi helem. Gaz bezwładny zastąpił wybuchowy wodór w statkach powietrznych i balonach. Na przykład w meteorologii kulki z helem są używane do podnoszenia przyrządów pomiarowych.
- W technologii kriogenicznej służy jako płyn chłodzący, ponieważ temperatura tego pierwiastka chemicznego w stanie ciekłym jest możliwie najmniejsza.
- Hel, którego właściwości zapewniają niską reaktywność i rozpuszczalność w wodzie (i krwi), w mieszaninie z tlenem, znalazły zastosowanie w kompozycjach oddechowych do nurkowania z akwalungiem i wykonywania pracy kasetowej.
- Meteoryty i skały są analizowane pod względem zawartości tego pierwiastka w celu określenia ich wieku.
Hel: właściwości pierwiastków
Główne właściwości fizyczne On są następujące:
- Liczba atomowa: 2.
- Względna masa atomu helu: 4,0026.
- Temperatura topnienia: nie.
- Temperatura wrzenia: -268,9 ° C.
- Gęstość (1 atm, 0 ° C): 0,1785 g /
- Stany utleniania: 0.

















