okresowy pierwiastków Mendelejewa i prawo okresowe
W XIX wieku silny reformacji przeszedł wiele obszarów, w tym chemii. układu okresowego Mendelejewa, przygotowanym 1869 doprowadziła do wspólnego zrozumienia zależności między położeniem prostych substancji okresowego, ustalenie związku pomiędzy względną masę atomową i elementu wartościowość własności.
Domendeleevsky chemia między
Nieco wcześniej, na początku XIX wieku, liczne próby usystematyzowania pierwiastków chemicznych. Niemiecki chemik Johann Wolfgang Döbereiner spędził pierwszą poważną pracę na systematyzacji w dziedzinie chemii. Postanowił, że wiele podobnych substancji we właściwościach można pogrupować – triadę.
Niedokładność przedstawień niemieckiego naukowca
Istotą prawa reprezentowanego przez Johann Wolfgang Döbereiner Triady określona tak, że ciężar atomowy substancji jest blisko połowa sumy (wartość średnia) mas atomowych dwóch ostatnich elementów triady tabeli. 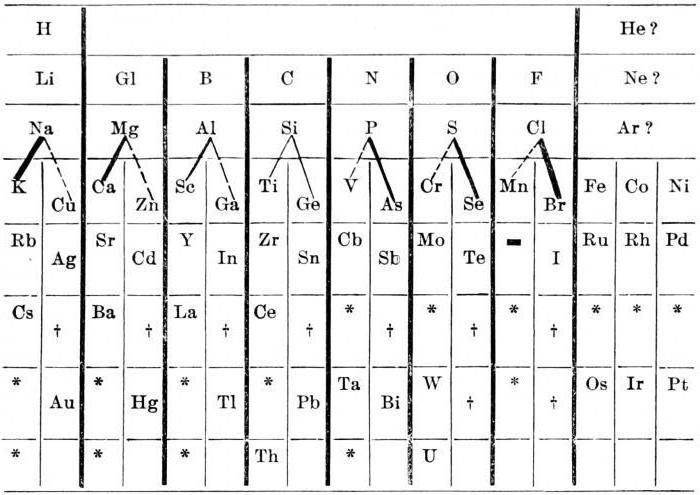 Jednakże brak magnezu w jednej podgrupie wapnia, strontu i baru była błędna.
Jednakże brak magnezu w jednej podgrupie wapnia, strontu i baru była błędna.
Takie podejście było konsekwencją sztucznych ograniczeń podobnych substancji tylko triodyty. Johann Wolfgang Döbereiner widział podobieństwa parametrów chemicznych i fosforu, arsenu, antymonu i bizmutu. Jednak ograniczył się Odzyskiwanie triad. W rezultacie, nie był w stanie przyjść do prawidłowej klasyfikacji pierwiastków chemicznych.
Zgodnie z istniejącymi elementami, AT Johann Wolfgang Döbereiner triady, oczywiście, nie było to możliwe, prawo wyraźnie wskazują na obecność związek pomiędzy względną masę atomową i chemicznych właściwości substancji prostych.
pierwiastki chemiczne usystematyzowanie Sposób
Wszystkie kolejne próby usystematyzować polegać na rozkład pierwiastków w zależności od ich masy atomowej. Później hipoteza Johann Wolfgang Döbereiner została wykorzystana przez innych chemików. Wprowadzony tworzących triady, tetrady i pentad (łączenie w grupy elementów trzech, czterech i pięciu).
W drugiej połowie XIX wieku było kilka prac jednocześnie, na podstawie którego Dymitr Iwanowicz Mendelejew chemia doprowadziło do całkowitego systematyzacji pierwiastków chemicznych. Odmienna struktura układu okresowego doprowadził do rewolucyjnego zrozumienia i dowód prosty mechanizm dystrybucji substancji.
okresowy pierwiastków Mendelejewa pierwiastków
Na spotkaniu rosyjskiego Towarzystwa Chemicznego na wiosnę 1869 roku było przeczytać informację w rosyjski naukowiec D. I. Mendeleeva o swoim odkryciu układu okresowego pierwiastków chemicznych prawa.  Pod koniec tego samego roku, pierwsza praca „Podstawy chemii”, pierwszy układu okresowego pierwiastków zawartych w nim zostały opublikowane.
Pod koniec tego samego roku, pierwsza praca „Podstawy chemii”, pierwszy układu okresowego pierwiastków zawartych w nim zostały opublikowane.
W listopadzie 1870 roku, pokazał kolegów Ponadto, „naturalny system elementów i używać go w kierunku cech elementów nieodkrytych”. W tej pracy D. I. Mendelejew pierwszy użył terminu „prawo okresowe”. Układu okresowego pierwiastków na podstawie prawa okresowych definiuje możliwości istnienia substancji prostych nie otworzyć i wyraźnie wskazuje na ich właściwości.
Korekty i uściślenia
W rezultacie, przez 1971 ustawa okresowe i układu okresowego pierwiastków o Mendelejewa zostały zmodyfikowane i uzupełnione przez rosyjskiego chemika.
Ostatni artykuł „okresowego pierwiastków prawo” definiująca zestaw naukowiec prawa okresowej, co wskazuje, że właściwości ciał prostych właściwości związków i tworzą kompleks korpusów bezpośredniej zależności ustalane są w zależności od ich masy atomowej.
Nieco później, w 1872 roku, struktura układu okresowego została przekształcona w postaci klasycznego (tryb krótki okres rozkładu). 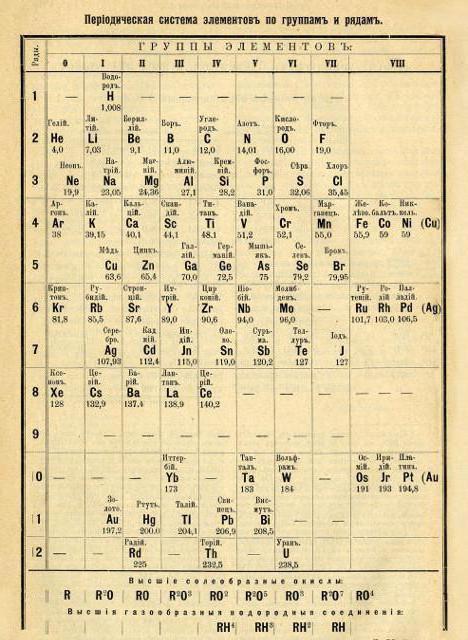
W przeciwieństwie do swoich poprzedników, rosyjski chemik w pełni wykonany stół, wprowadził pojęcie prawidłowości masy atomowe pierwiastków chemicznych.
Charakterystycznymi elementami układu okresowego i praw pochodnych pozwoliły naukowcom opisać właściwości pierwiastków jeszcze na odkrycie. Mendelejewa polegać na tym, że właściwości poszczególnych substancji może być ustalona w zależności od właściwości tych dwóch przylegających elementów. Nazwał ją zasada „gwiazd”. Jej istotą jest to, że pierwiastki z tabeli do określenia właściwości wybranego elementu koniecznego do prowadzony poziomo i pionowo w pierwiastków chemicznych.
Układ okresowy Mendelejewa jest w stanie przewidzieć …
Pierwiastków Mendelejewa, pomimo jego dokładność i wierność, nie został uznany przez społeczność naukową w pełni. Niektóre z wielkich uczonych światowej sławy otwarcie wyśmiewane możliwość przewidywania właściwości pierwiastków odkrytych. Dopiero w 1885 roku, po odkryciu przewidywanych elementów – Eka-aluminium i ekabora ekasilitsiya (galu, skand i german), nowy system klasyfikacji prawa okresowego Mendelejewa i zostały uznane za teoretycznych podstaw chemii.
Na początku XX wieku, struktura układu okresowego wielokrotnie korygowane. W procesie pozyskiwania nowych danych naukowych D. I. Mendelejewa i jego kolega William Ramsay doszedł do wniosku o konieczności wprowadzenia grupy zerowej. W swoim składzie zawiera gazy szlachetne (hel, neon, argon, krypton, ksenon i radon).
W tysiąc dziewięćset jedenastego roku Soddy złożyła wniosek do umieszczenia nieodróżnialne pierwiastki chemiczne – izotopy – w pojedynczej komórce tabeli.
W trakcie długiej i żmudnej pracy układu okresowego pierwiastków chemicznych układu okresowego została sfinalizowana, a nabyte nowoczesny wygląd. Jego struktura składa się z ośmiu grup i siedem okresów. Grupy – są okresy pionowe kolumny – poziome. Grupy zdefiniowane podział na podgrupy. 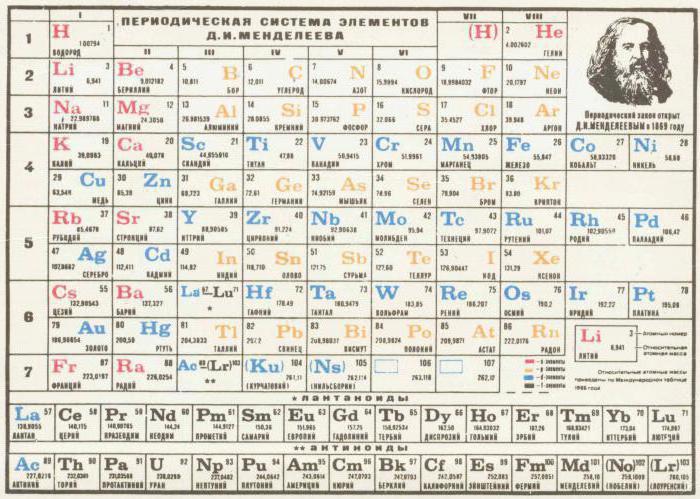
Położenie w elemencie tabeli wskazuje jego elektronów walencyjnych i funkcje czysto chemicznych. Jak się okazało, w rozwoju układu okresowego, wykryto Koincydencja liczbę elementów elektronu z numeru seryjnego.  Fakt ten jest jeszcze bardziej uproszczone zrozumienia zasady interakcji prostych substancji i tworzenie się kompleksu. Sposób w odwrotnym kierunku. Obliczanie ilości tego materiału, a także konieczne dla reakcji chemicznej teoretycznie dostępny.
Fakt ten jest jeszcze bardziej uproszczone zrozumienia zasady interakcji prostych substancji i tworzenie się kompleksu. Sposób w odwrotnym kierunku. Obliczanie ilości tego materiału, a także konieczne dla reakcji chemicznej teoretycznie dostępny.
Rola odkrycia Mendelejewa współczesnej nauki
System Mendelejew i jego podejście do uporządkowania pierwiastków chemicznych określił sensownego rozwoju chemii. Przy właściwym rozumieniu stosunku stałych i analizę chemiczną Mendelejewa może prawidłowy montaż i elementów pogrupowanych w zależności od ich właściwości.  Nowa tabela elementów pozwala jasno i precyzyjnie obliczyć dane przed reakcją chemiczną, przewidywania nowych elementów oraz ich właściwości.
Nowa tabela elementów pozwala jasno i precyzyjnie obliczyć dane przed reakcją chemiczną, przewidywania nowych elementów oraz ich właściwości.
Otwarcie rosyjskiego naukowca miało bezpośredni wpływ na dalszy przebieg rozwoju nauki i technologii. Nie ma obszar technologiczny, który nie byłby zaangażowany znajomości chemii. Być może, gdyby takie odkrycie nie stało, nasza cywilizacja miałaby inną ścieżkę rozwoju.














