Węglowodory – bardzo szerokiej klasy związków związanych z organicznym. Obejmują one kilka głównych grup substancji, wśród których prawie każdy znajdzie szerokie zastosowanie w przemyśle, życia, natury. Szczególnie ważne są chlorowcowane węglowodory, które zostaną omówione w artykule. Nie tylko wysoką wartość handlową, ale również ważnym surowcem dla wielu syntez chemicznych, do wytwarzania leków i innych ważnych związków. Zwracamy szczególną uwagę na ich strukturze molekularnej, właściwości i innych cech.

Chlorowcowane węglowodory: ogólne cechy
Z punktu widzenia chemii, do tej klasy związków są te wszystkie węglowodory, w których jeden lub więcej atomów wodoru zostało zastąpionych przez jedną lub inny halogen. Jest to bardzo szeroka kategoria substancji, ponieważ są one bardzo duże znaczenie przemysłowe. W ciągu stosunkowo krótkiego okresu czasu ludzie nauczyli się syntetyzować praktycznie wszystkie chlorowcowane węglowodory, których stosowanie jest konieczne w medycynie, przemyśle chemicznym, przemyśle spożywczym i życiu codziennym.
Podstawowy sposób wytwarzania tych związków – Sposób syntezy w warunkach laboratoryjnych i przemysłowych, a także w charakterze niemal żadna z nich nie występuje. W związku z chlorowcem są bardzo reaktywne. To w dużej mierze decyduje o ich zastosowanie w syntezie chemicznej jako produktu pośredniego.
Jako przedstawiciele chlorowcowęglowodory dużo, aby je klasyfikować według różnych kryteriów. Podstawą leży zarówno strukturę i mnogość połączeń obwodów, a różnica atomami halogenu i miejsca ich lokalizacji.
Chlorowcowane węglowodory: Klasyfikacja
Pierwszy przykład oddzielania się według ogólnie przyjętych zasad, które stosuje się do wszystkich związków organicznych. Klasyfikacja na podstawie różnicy w rodzaju łańcucha węglowego, jego cykliczności. Na tej podstawie emitować:
- ograniczania chlorowcowane węglowodory;
- nienasycone;
- aromatyczny;
- alifatyczny;
- acykliczny.
Następne rozdzielanie na bazie atomu fluorowca i zawartości ilościowej w cząsteczce. Zatem zwolnienie:
- monoderivatives;
- diproizvodnye;
- tri-;
- tetra;
- pentaproizvodnye i tak dalej.
Jeśli mówimy o halogenem, a następnie nazwę podgrupy składa się z dwóch słów. Na przykład, monohlorproizvodnoe, triyodproizvodnoe, tetrabromgalogenalken i tak dalej.
Ponadto, istnieje inny przykład klasyfikacji, które są oddzielone, korzystnie fluorowcowanych nasyconych węglowodorów. Jest to numer atomu węgla, do którego przyłączony jest atom fluorowca. Zatem zwolnienie:
- pochodne podstawowej;
- średnie;
- trzeciorzędowy, i tak dalej.
Każda jednostka przedstawiciel może być uporządkowane według wszystkich wskazań i określenia pełnego miejsce w systemie związków organicznych. Na przykład, związek o składzie CH3 – CH 2-CH = CH-CCL 3 może być zaklasyfikowana jako. To nie jest ograniczenie alifatyczny trihlorproizvodnoe penten.
struktura molekularna
Obecność atomów fluorowca nie można jednak wpływać jednocześnie właściwości fizyczne i chemiczne oraz ogólną strukturę cząsteczki. Wzór ogólny dla tej klasy związków jest w postaci R-Hal, w którym R – rodnik węglowodorowy wolne od struktury, a Hal – atom chlorowca, jedna lub więcej. Komunikacja między węgla i halogenu silnie spolaryzowanym, przy czym cząsteczki jako całości, zazwyczaj dwa efekty:
- Indukcyjność ujemny;
- mesomeric pozytywne.
W tym przypadku, z których pierwszy jest znacznie silniejsze, tak atom Hal zawsze wykazuje właściwości odciągającą elektrony podstawnik.
We wszystkich innych cech strukturalnych cząsteczek, nie różnią się od konwencjonalnych węglowodory. Właściwości wyjaśnione struktury i rozgałęzienie łańcucha, liczbę atomów węgla, zapachowe siły.
Szczególną uwagę należy nomenklatury chlorowcowane węglowodory. Jak nazwać połączenie danych? Aby to zrobić, trzeba przestrzegać kilku zasad.
- Łańcuch numeracja rozpoczyna się od krawędzi, która znajduje się tym bliżej atom fluorowca. Jeżeli istnieje wiązanie wielokrotne odliczanie rozpoczyna się od niej, a nie z podstawnikami odciągającymi elektron.
- Nazwa Hal wskazano w prefiks, należy również wskazują liczbę atomów węgla od którego odchodzi.
- Ostatnim krokiem jest nazwano głównych węgla w łańcuchu (lub pierścienie).
Przykładem takich nazwami: CH2 = CH-CHCI2 – 3-dichloropropenu-1.
Nazwa może mieć racjonalne i nomenklatura. W tym przypadku, grupę wymówić nazwę, a następnie – z przyrostkiem przełącznika -id halogen. Przykład: CH3-CH2-CH2-Br – bromek propylu.
Jak inne klasy związków organicznych, chlorowcowane węglowodory o określonej struktury. Pozwala to wielu członków wyznaczają historyczne nazwy. Na przykład, halotan CF3 CBrClH. Dostępność trzech halogenów w cząsteczce zapewnia szczególne właściwości substancji. Jest on stosowany w medycynie, a więc jest bardziej prawdopodobne, aby używać nazw historycznych.

metody syntetyczne
Sposoby wytwarzania fluorowcowane węglowodory są dość zróżnicowane. Istnieje pięć podstawowych sposobów syntezy tych związków w laboratorium i przemyśle.
- Chlorowcowanie normalnej konstrukcji konwencjonalnego węglowodory. Ogólny schemat reakcji: Rh + Hal 2 → R-Hal + HHal. Charakterystyka procesu są następujące: z chloru i bromu pewno na promieniowanie UV, reakcja z jodem jest praktycznie niemożliwe lub bardzo powolny. Ponieważ oddziaływanie fluor za aktywny, więc używać aktywny chlorowiec w czystej postaci nie może. Ponadto, chlorowcowaniem związków aromatycznych pochodnych należy używać specjalnego procesu katalizatorów – kwasu Lewisa. Na przykład, chlorek żelaza lub aluminium.
- Wytwarzanie węglowodorów chlorowcowanych są prowadzone przez gidrogalogenirovaniya. Jednakże, wstępne związek musi być nienasycony węglowodór. Przykład: R = RR + HHal → RR-RHal. Ponadto w najbardziej podobny elektrofilowym stosuje się w celu uzyskania chloroethene lub chlorku winylu, ponieważ związek ten jest ważnym surowcem do syntez w przemyśle.
- Efekty alkoholi gidrogalogenov. Ogólna forma reakcji: R-OH + HHal → R Hal + H 2O w jednym aspekcie obowiązkowego obecności katalizatora. Przykłady procesu przyspieszających, które można stosować: chlorki fosforu, siarki, cynku i żelaza, kwas siarkowy, dodaje się roztwór chlorku cynku w kwasie chlorowodorowym – odczynnik Lucas.
- Dekarboksylację soli kwasowych w obecności czynnika utleniającego. Inną nazwą dla sposobu – reakcja Borodin-Hunsdikkera. Istota polega na tym, rozszczepianie cząsteczki dwutlenku węgla ze srebra pochodne kwasów karboksylowych, po wystawieniu na działanie czynnika utleniającego, – halogen. W efekcie tworzą się chlorowcowane węglowodory. Reakcje na ogół w następujący sposób: R Hal → COOAg + R -Hal + CO 2 + AgHal.
- Synteza galoformov. Innymi słowy, metan odbiór trigalogenproizvodnyh. Najprostszym sposobem ich produkcji – wystawienie na aceton alkalicznych halogenów roztworu. W rezultacie, istnieje cząsteczki tworzenie galoformnyh. Zsyntetyzowano w ten sam sposób w branży chlorowcowane węglowodory aromatyczne.
Szczególną uwagę należy zwrócić na syntezy nienasyconych przedstawicieli tej klasy. Podstawowy sposób – jest wpływ na alkiny soli rtęci i miedzi w obecności atomów halogenu, co prowadzi do produktu zawierającego wiązanie podwójne w łańcuchu.
Chlorowcowane węglowodory aromatyczne, otrzymuje się przez reakcje chlorowcowania arenów i alkylarene łańcucha bocznego. Są to ważne produkty przemysłowe, ponieważ są one używane jako środki owadobójcze w rolnictwie.
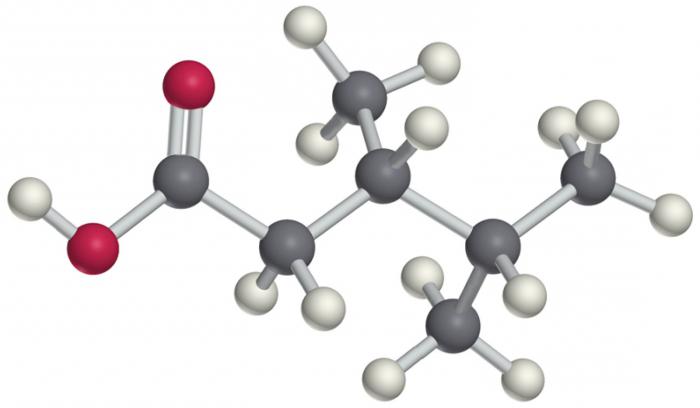
właściwości fizyczne
Właściwości fizyczne fluorowcowane węglowodory są bezpośrednio zależne od struktury cząsteczki. W temperaturze wrzenia i stan topnienia agregacji wpływają na liczbę atomów węgla w łańcuchu oraz możliwe gałęzi w części bocznej. Tym bardziej, że dane są wyższe. Ogólnie można scharakteryzować parametry fizyczne w kilku punktach.
- Wygląd: pierwszy dolny przedstawicieli – gazów, po ich C12 – ciecz powyżej – ciało stałe.
- Mają ostry nieprzyjemny specyficzny zapach, niemal wszystkich przedstawicieli.
- Bardzo słabo rozpuszczalny w wodzie, ale dla siebie – doskonałymi rozpuszczalnikami. Związki organiczne, rozpuszcza się bardzo dobrze.
- Wrzenia i topnienia wzrost temperatury wraz ze wzrostem liczby atomów węgla w łańcuchu głównym.
- Wszystkie połączenia, z wyjątkiem fluoru pochodnych cięższych niż woda.
- Im więcej gałęzi w głównym łańcuchu, niższy punkt wrzenia substancji.
Trudno zidentyfikować wiele podobnych cech wspólnych, ponieważ przedstawiciele różnią się znacznie pod względem składu i struktury. W związku z tym, lepsze wartości wynikowe dla każdego konkretnego związku z tego szeregu węglowodorów.
właściwości chemiczne
Jednym z najważniejszych parametrów, które należy wziąć pod uwagę przemysł i syntezy chemiczne reakcje chemiczne chlorowcowanych węglowodorów. One nie są takie same dla wszystkich członków, jak istnieje wiele przyczyn tej różnicy.
- Konstrukcja łańcucha węglowego. Najprostszą drogą reakcji podstawienia nukleofilowego (typ) pochodzą z drugorzędowych i trzeciorzędowych halogenków alkilowych.
- Typ Halogen jest również ważna. Komunikacja między węglem a Hal jest silnie spolaryzowane, a to, że zapewnia łatwy pęknięcia, aby zwolnić wolne rodniki. Jednakże najłatwiejszym sposobem komunikowania rozdziera pomiędzy jodem i węgla ze względu na naturalne zmiany (redukcji) w energii wiązania w serii F-Cl-Br-I.
- Obecność aromatycznych wiązań rodnik lub wielu.
- Struktura i rozgałęzienie rodnika.
Na ogół, najlepiej do alkilu halogenki reagują dokładnie nukleofilowego podstawienia. Po atomem węgla po rozerwaniu na skutek halogen częściowo zatęża ładunek dodatni. Pozwala to rodnik całości osiągnięcia cząstki eletronootritsatelnyh akceptora. Na przykład:
- OH -;
- SO 4 2;
- Nr 2 -;
- CN – i inni.
Wyjaśnia to fakt, że z chlorowcowanym węglowodorem może się prawie dowolnej klasy związków organicznych tylko wybrać odpowiedni reagent, który dostarczy wymaganą funkcjonalność.
Ogólnie rzecz biorąc można stwierdzić, że właściwości chemiczne chlorowcowanego węglowodoru w stanie prowadzić następującymi interakcji.
- Z nukleofilowymi cząstek różnego rodzaju – reakcji podstawienia. W rezultacie może być alkohole, etery, estry, związki nitrowe, aminy, nitryle, kwasy karboksylowe.
- Reakcję eliminacji lub dehydrohalogenowanie. Wskutek alkoholowym roztworem cząsteczki halogenku alkalicznego odszczepiać. Tak utworzony alkenu o niskiej masie cząsteczkowej, produkty uboczne – i słonej wody. Przykład z reakcją: CH3-CH2-CH2-CH2-Br + NaOH (alkohol) → CH 3-CH 2-CH = CH2 + NaBr + H2O Te procesy – jedna z głównych metod syntezy alkenów ważne. Proces ten jest zawsze towarzyszą wysokie temperatury.
- Preparat prawidłowej struktury alkany metody syntezy Wurtza. Istotą reakcji polega na wystawieniu fluorowco-podstawiony węglowodór (dwie cząsteczki) metalicznego sodu. Jak silnie elektrododatni jonów sodu przyjmuje atomów halogenu z tego związku. W rezultacie, uwolnione rodniki węglowodorowe są zamknięte pomiędzy wiązaniem, alkan tworzenia nowych konstrukcji. Przykład: CH3-CH2 Cl + CH 3 CH 2Cl + 2Na → CH 3-CH 2-CH 2-CH 3 + 2NaCl.
- homologi syntezy węglowodorów aromatycznych, przez reakcję Friedel-Craftsa. Istotą tego procesu – poddawania benzenu fluorowcoalkilową, w obecności chlorku glinu. W wyniku reakcji podstawienia toluenu i tworzenia chlorowodoru. W tym przypadku obecność katalizatora nie jest konieczne. Poza benzenem, w ten sposób może być utleniony i jego homologów.
- Preparat Grenyara cieczą. Odczynnik ten jest fluorowco-podstawiony węglowodór jonów magnezu w kompozycji. Początkowo prowadzi się wpływ metalu magnezu w powietrzu na fluorowcoalkilu pochodnego. Rezultatem jest kompleks o ogólnym wzorze RMgHal, w odniesieniu odczynnika Grenyara.
- Redukcja do alkanu, alkenu (aren). Przeprowadzone pod wpływem wodoru. Wynikiem jest węglowodór i produktu ubocznego – chlorowcowodór. Przykładem o ogólnej postaci: R-Hal + H2 RH + → HHal.
Jest to podstawowa interakcji, które można łatwo wprowadzić chlorowcowane węglowodory o różnej konstrukcji. Oczywiście, istnieje również konkretne reakcje, które powinny być brane pod uwagę dla każdego przedstawiciela.
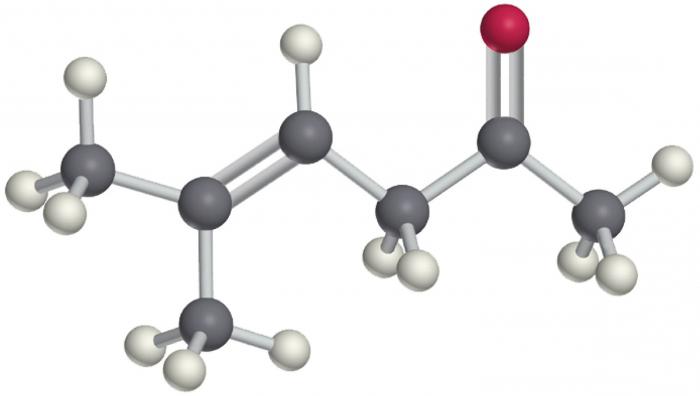
izomerów cząsteczek
Izomeria chlorowcowane węglowodory – zjawisko całkowicie naturalne. Wiadomym jest, że im więcej atomów węgla w łańcuchu, a im większa liczba form izomerycznych. Ponadto, nienasycone przedstawicielom wielu wiązań, które również staje się przyczyną izomerów.
Dwie główne odmiany tego zjawiska do tej klasy związków można zidentyfikować.
- Izomeria rodnik a szkielet węglowy łańcuch główny. To mogą być również przypisane do pozycji wielokrotne wiązania, jeśli jest obecny w cząsteczce. Podobnie jak w przypadku prostych węglowodorów od trzeciego wzoru przedstawiciel może rejestrować związki mające identyczne cząsteczkowy, ale inną strukturalną FORMULAR ekspresji. Ponadto, liczba form izomerycznych o rząd wielkości większe niż odpowiednie alkany (alkenów, alkinów, arenów i tak dalej) do węglowodorów halogenowych.
- Stanowisko fluorowca w cząsteczce. Jego liczba gniazdo oznaczone w tytule, nawet wtedy, gdy tylko jedna zmiana właściwości tych izomerów będzie zupełnie różny.
izomeria przestrzenna tutaj nie mówimy, jak atomy halogenu to niemożliwe. Podobnie jak w przypadku wszystkich innych związków organicznych w haloalkili izomery różnią się nie tylko w budowie, ale również właściwości fizycznych i chemicznych.

Pochodne nienasyconych węglowodorów
Takie związki, oczywiście, wiele. Jednak jesteśmy zainteresowani halogenowych węglowodorów nienasyconych. Mogą też być podzielone na trzy główne grupy.
- Winylu – gdy atom Hal się bezpośrednio na atomie węgla wiązaniem wielokrotnym. Cząsteczka PRZYKŁAD: CH2 = CCL 2.
- Z izolowanym miejscu. Atom fluorowca, a wiązanie wielokrotne, znajduje się w przeciwległych częściach cząsteczki. Przykład: CH2 = CH-CH 2-CH 2-CI.
- pochodne allilowe, – atom chlorowca wiązanie podwójne znajduje się przez jeden atom węgla, który jest przechowywany w położeniu alfa. Przykład: CH2 = CH-CH2-CL.
Szczególne znaczenie ma związek, takie jak chlorek winylu, CH2 = CHCI. Jest zdolny do polimeryzacji reakcje tworząc ważne produkty, takie jak izolacja, wodoodpornej tkaniny i tak dalej.
Innym przedstawicielem nienasyconych pochodnych halogenowych – chloropren. Jego wzór – SN₂ = CCL-CH = SN₂. Związek ten jest materiałem wyjściowym do syntezy kauczuków, które różnią się odporność ogniową, długą żywotność, niską przepuszczalność dla gazów.
Tetrafluoroetylenu (lub teflon), – polimer ma wymagania jakościowe. Stosowany do produkcji cennych pokrycie szczegółów technicznych, naczynia, różnych urządzeń. Wzór – CF2 = CF2.
węglowodory aromatyczne i ich pochodne
Związki aromatyczne są te, które zawierają pierścień benzenowy. Wśród nich również całą grupę halogen. Można wyróżnić dwa główne typy nich w strukturze.
- Jeśli Hal atom jest połączony bezpośrednio do rdzenia, to jest pierścieniem aromatycznym, a następnie związek jest nazywany fluorowcoareny.
- Atom fluorowca nie jest przyłączony do pierścienia i węgla w łańcuchach bocznych, to jest rodnika ścieków do gałęzi bocznej. Związki te zwane są halogenki alkilowe, arylowe.
Wśród przedmiotowych substancji można nazwać kilku członków, które mają największe znaczenie praktyczne.
- Heksachlorobenzen – C 6-Ci-6. Od początku XX wieku był używany jako potężny środek grzybobójczy i owadobójczy. Ma dobry efekt dezynfekujący, więc używany jest do zaprawiania nasion przed pokazów. Ma nieprzyjemny zapach, wystarczy płyn żrący, jasne, może powodować łzawienie.
- Bromek C 6H 5CH 2 Br. Jest on stosowany jako ważny reagent w syntezie związków metaloorganicznych.
- Chlorobenzen C 6H 5 Cl. Bezbarwna substancja ciecz o specyficzny zapach. Wykorzystywane w produkcji barwników, pestycydów. Jest to jedna z najlepszych rozpuszczalników organicznych.

Zastosowanie w przemyśle
Chlorowcowane węglowodory użyć przemysłu swego i syntezy chemicznej są bardzo szerokie. O przedstawicieli nienasyconych i aromatycznych mówiliśmy. Oznaczają obecnie ogólnie wykorzystanie tej serii związków.
- W budownictwie.
- Jako rozpuszczalniki.
- W procesie wytwarzania wyrobów włókienniczych, gumy, kauczuku, barwniki, materiały polimerowe.
- Do syntezy wielu związków organicznych.
- pochodne fluorowe (CFC) – A chłodnicze w instalacjach chłodniczych.
- Stosowane jako pestycydy, insektycydy, fungicydy, oleje, lakiery, żywice, środki smarujące.
- Idź do produkcji materiałów izolacyjnych, i tak dalej.













