Rozcieńczony i stężony kwas siarkowy – to jest tak ważnych substancji chemicznych, które produkują więcej w świecie niż jakiejkolwiek innej substancji. bogactwo gospodarcza kraju mogą być oceniane pod względem wytwarzanego kwasu siarkowego w nim.
proces dysocjacji
Kwas siarkowy stosuje się w postaci wodnych roztworów o różnych stężeniach. Przechodzi ona reakcję rozszczepienia w dwóch etapach wytwarzania jonów H + są w roztworze.
H 2SO 4 + H + = HSO 4 -;
HSO 4 – = H + SO 4-2.
Kwas siarkowy jest silnym, a pierwszy etap dysocjacji następuje tak szybko, że prawie wszystkie cząsteczki pierwotnej rozkładają się jony H + oraz HSO 4 -1 jony (siarczan wodoru) w roztworze. Najnowsze częściowo rozpada się dalej, uwalniając jony H + drugi pozostawiając jon siarczanu (SO 4-2) w roztworze. Jednakże, wodorosiarczan, jest kwasem słabym, trwa nadal w roztworze H + i SO4 -2. Kompletna dysocjacji jest tylko wówczas, gdy gęstość roztworu kwasu siarkowego w pobliżu gęstości wody, R f. Przy dużym rozcieńczeniu. 
Właściwości kwasu siarkowego
Jest to szczególny w tym sensie, że może działać jako konwencjonalnego kwasu lub silnego utleniacza – w zależności od temperatury i stężenia. Zimny rozcieńczony roztwór kwasu siarkowego poddaje się reakcji z aktywnym metalem, otrzymując sól (siarczan) i wydzielanie wodoru. Na przykład, reakcję pomiędzy zimnym rozcieńczonym H 2SO 4 (zakładając jej pełnej etap dysocjacji) i metaliczny cynk w następujący sposób:
Zn + H = 2 SO 4 ZnSO 4 + H2.
Gorący stężony kwas siarkowy o gęstości około 1,8 g / cm3, może działać jako utleniacza, poddaje się reakcji z materiałów, które są na ogół obojętne z kwasami, takimi jak na przykład miedź metaliczną. Podczas reakcji miedzi utlenia się, a masa kwas zmniejszona wytworzenia roztworu siarczanu miedzi (II) w wodzie i gazowego ditlenku siarki (SO2) zamiast wodoru, które są wymagane przez reakcję kwasu z metalem.
Cu + 2 H 2SO 4 = CUSO4 + SO2 + 2H 2O 
Ogólnie ekspresji stężenia roztworów
Faktycznie, stężenie każdego roztworu może być wyrażone w różnych sposobów, ale najczęściej używane stężenie wagowe. Pokazuje ilość gramów substancji rozpuszczonej w określonej masie lub objętości roztworu lub rozpuszczalnika (typowo 1000 g, 1000 cm3, 100 cm3 do 1 dm3). Zamiast masy w gramach substancji może przyjmować wielkość, wyrażoną w molach, – następnie otrzymany stężenie molowe 1000 g lub 1 dm3 roztworu.
Jeśli stężenie molowe określono w odniesieniu do wartości nie do roztworu lecz do rozpuszczalnika, to jest nazywany molalność roztworu. Charakteryzuje się niezależności od temperatury.
Często stężenie masy podano w gramach na 100 gramów rozpuszczalnika. Pomnożenie tej liczby przez 100%, to otrzymuje się w procentach wagowych (na stężenie). Oznacza to, że metoda ta jest najczęściej stosowana w zastosowaniu do roztworu kwasu siarkowego.
Każda wartość stężenia roztworu określonego w danej temperaturze, odpowiada bardzo gęstości (na przykład, gęstość roztworu kwasu siarkowego). Dlatego czasami charakteryzuje roztworu. Na przykład, H 2SO 4 rozwiązania, znamienny procentowe stężenie 95,72%, gęstości od 1,835 g / cm3, w czasie t = 20 ° C. Jak określić stężenie takiego roztworu, jeśli podano tylko gęstość kwasu siarkowego? Tabela daje taką korespondencji osprzętu z każdym podręczniku chemii analitycznej lub ogólnego.
Przykład stężenie ponowne obliczenie
Puścić z jednego trybu do innego wyrazu stężenia roztworu. Załóżmy, że mamy H 2SO 4 rozwiązanie w wodzie o stężeniu 60% zainteresowania. Najpierw określić gęstość odpowiedniego kwasu siarkowego. Tabeli zawierającej wartości procentowe (pierwsza kolumna) z odpowiednią gęstość wodnego roztworu H 2SO 4 (czwarta kolumna), przedstawiono poniżej. 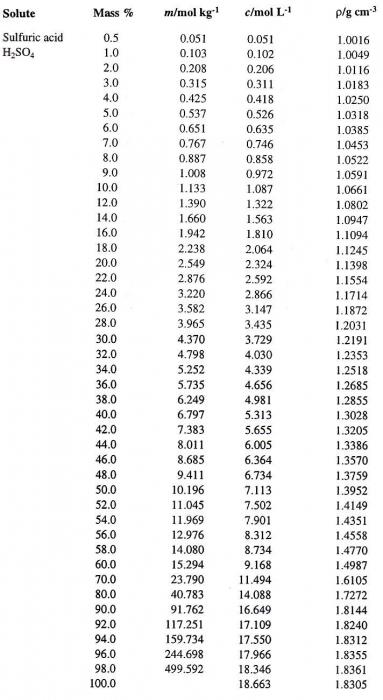
To określa żądaną wartość, która jest równa 1.4987 g / cm3. Mamy teraz obliczyć stężenie molowe roztworu. W tym celu konieczne jest, w celu określenia masy H2 SO4 w 1 litrze roztworu, a odpowiadającej liczbie moli kwasu.
Wielkość, które zajmują się 100 g roztworu macierzystego:
100 / 1,4987 = 66,7 ml.
Ponieważ w 66,7 ml 60% roztworu zawierało 60 g kwasu w 1 litrze, że zawierają:
(60 / 66,7) x 1000 = 899, 55g.
Kwas siarkowy ciężar molowy równy 98. Tak więc, liczba moli zawartych w 899.55 g jego gramach wynosi:
899,55 / 98 = 9,18 mol.
Zależność gęstości od stężenia kwasu siarkowego, jest pokazany na fig. poniżej. 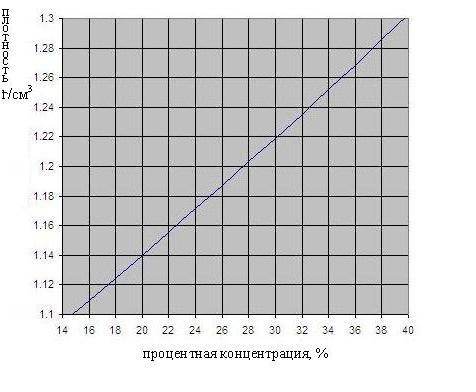
Zastosowanie kwasu siarkowego
Jest on stosowany w różnych gałęziach przemysłu. Przy produkcji żeliwa i stali, stosuje się do oczyszczania powierzchni metalowej przed pokryte inną substancją udział w tworzeniu barwników syntetycznych, jak również innych typów kwasów, takich jak kwas solny i azotowy. Jest on również stosowany do wytwarzania produktów farmaceutycznych, nawozami i materiałów wybuchowych i jest ważnym reagentem w usuwaniu zanieczyszczeń z ropy naftowej w przemyśle rafinacji.
Substancja ta jest bardzo użyteczna w życiu codziennym i jest łatwo dostępna, jak wykorzystywany w akumulatorach ołowiowo-kwasowych (na przykład tych, które znajdują się w samochodach) roztwór kwasu siarkowego. Kwas taki ma na ogół w stężeniu od około 30% do 35% H 2SO 4 wagowych, a resztę – woda.
Dla wielu zastosowań konsumenckich 30% H 2 SO 4 będzie więcej niż wystarczająco, aby zaspokoić swoje potrzeby. Jednakże, w przemyśle i wymaga znacznie wyższego stężenia kwasu siarkowego. Zazwyczaj podczas wytwarzania jest on najpierw uzyskać wystarczająco rozcieńczony i zanieczyszczonego wtrąceniami organicznych. stężony kwas otrzymuje się w dwóch etapach: Po pierwsze, doprowadzono do 70%, a następnie – w drugim etapie – podnosi się do 96-98%, co jest parametrem ograniczającym ekonomicznie opłacalnej produkcji.
Gęstość kwasu siarkowego i jego odmian
Mimo, że prawie 99% kwas siarkowy, może być na krótko w temperaturze wrzenia, a następnie utratę SO3 w temperaturze wrzenia zmniejsza stężenie 98,3%. Na ogół, gatunki z indeksem 98%, bardziej stabilne w czasie przechowywania.
kwasy handlowe klasy różnią się w interesującym stężeniu, a do którego jest wybrany te wartości, w których niska temperatura krystalizacji. Ma to na celu zmniejszenie strat kryształów kwasu siarkowego wytrącają się podczas transportu i przechowywania. Główne odmiany są:
- Wieży (azotu), – 75%. Gęstość kwas siarkowy klasy jest równa 1670 kg / m3. Uzyskać jego tzw. Sposób azotu, w którym traktuje otrzymaną nitrozowa (to jest H 2SO 4, ale z rozpuszczonych tlenków azotu), w głównym wypalania kalcynowany surowego gazu zawierającego dwutlenek siarki, SO2, w uszczelnionych wież (stąd nazwa) odmian. W wyniku przydzielone tlenki kwasowe i azotu, które nie są wykorzystywane w tym procesie, i zawracane do cyklu produkcyjnego.
- Kontakt – 92,5-98,0%. Gęstość kwasu siarkowego 98% w klasie wynosi 1836.5 kg / m3. To też otrzymuje się z palarni gazów zawierających SO 2, znamienny tym, że proces obejmuje utlenianie dwutlenku bezwodnika do SO3 z kontaktu (stąd nazwa) gatunku z kilku warstw katalizatora wanadowego stałej.
- Oleum – 104,5%. Jej gęstość wynosi 1896,8 kg / m3. Ten roztwór SO3 w H 2SO 4, znamienny tym, że pierwszy składnik zawiera 20% i kwas – to 104,5%.
- Wysokiej jakości oleum – 114,6%. Gęstość – 2002 kg / m3.
- Bateria – 92-94%.
Jak działa akumulator samochodowy
Działanie to jeden z najbardziej popularnych urządzeń elektrycznych w całości oparte na procesach elektrochemicznych zachodzących w obecności wodnego roztworu kwasu siarkowego.
akumulator samochodowy zawiera rozcieńczonym kwasem siarkowym i dodatnich i ujemnych elektrod, w postaci kilku arkuszy. Płyty dodatnie są wykonane z czerwono-brązowy materiał – dwutlenek ołowiu (PbO 2) oraz negatywnych – szarawy „gąbki”, ołów (Pb).
Ponieważ elektrody są wykonane z ołowiu lub materiału ołowiowej, ten typ baterii jest często nazywany akumulator kwasowo-ołowiowy. Jej funkcjonalność, t. E. napięcie wyjściowe jest bezpośrednio określony przez to, co znajduje się w tym momencie gęstość kwasu siarkowego (kg / m3 g / cm 3), i wypełnia się, czy akumulator elektrolitem.
Co się dzieje z elektrolitem gdy rozładowaniu akumulatora
Elektrolit akumulator ołowiowo-kwasowy jest akumulator roztwór kwasu siarkowego w chemicznie czystej wody destylowanej w interesującym stężeniu 30% w pełne naładowanie. kwas netto ma gęstość od 1,835 g / cm 3, elektrolitu – około 1,300 g / cm3. Kiedy bateria jest rozładowana, to reakcje elektrochemiczne występują w wyniku czego kwas siarkowy wycofanego z elektrolitem. Stężenie roztworu zależy prawie proporcjonalna do gęstości, więc powinno zmniejszać z powodu spadku stężenia elektrolitów.
Tak długo, jak przepływa prąd rozładowania poprzez akumulator kwasowo jest szeroko stosowany w sąsiedztwie elektrody i elektrolit jest bardziej rozcieńczony. dyfuzji kwasu od całkowitej objętości elektrolitu i płytami elektrod umożliwia w przybliżeniu stałe natężenie reakcji chemicznej, a zatem napięcia wyjściowego.
Na początku procesu rozładowania dyfuzji elektrolitu kwasowego w tablicy następuje szybko, ponieważ uzyskana siarczanem jeszcze łącznie z porami w materiał aktywny elektrody. Kiedy siarczan zaczyna tworzyć i wypełniać pory elektrod, dyfuzja odbywa się wolniej.
Teoretycznie możliwe jest, aby kontynuować tak długo, jak rozładować nie zostaną wykorzystane wszystkie kwas, a elektrolit będzie składać się z czystej wody. Doświadczenie pokazuje jednak, że poziom nie powinien kontynuować po gęstość elektrolitu spadnie do 1,150 g / cm3.
Gdy gęstość zmniejsza się od 1,300 do 1,150, co oznacza, że większość siarczanu tworzy się podczas reakcji, i wypełnienie wszystkich porów materiału aktywnego na płytach, np. E. z roztworu już wybrana prawie cały kwas siarkowy. Gęstość zależy od stężenia proporcjonalnie, i podobnie, gęstość ładunku akumulatora zależy. Rys. poniżej przedstawia zależność gęstości elektrolitu akumulatora. 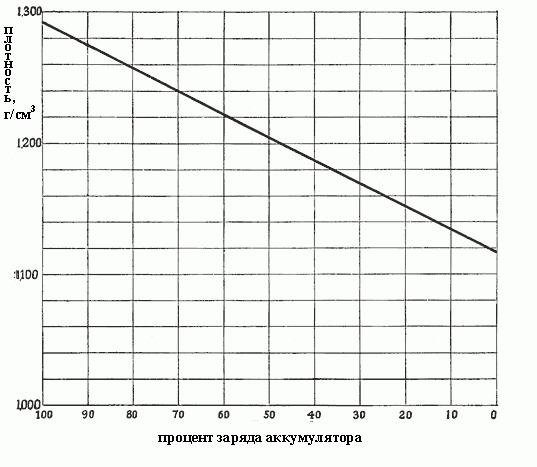
Zmiana gęstości elektrolitu, najlepszym sposobem określenia stanu rozładowania baterii, pod warunkiem, że jest właściwie wykorzystywane.
Degrees rozładowaniu akumulatora samochodu w zależności od gęstości elektrolitu
Jej gęstość powinna być mierzona co dwa tygodnie i muszą być zawsze czyta rekord przyszłego wykorzystania.
Im bardziej gęsty elektrolit, tym bardziej, że zawiera kwas a tym bardziej, że bateria jest naładowana. Gęstość 1,300-1,280 g / cm3, oznacza w pełni naładowana. Zazwyczaj po stopnia rozładowania baterii różnią się w zależności od gęstości elektrolitu:
- 1,300-1,280 – w pełni naładowana:
- 1,280-1,200 – ponad pół pusty;
- 1,200-1,150 – op mniej niż połowę;
- 1150 – prawie pusty.
W pełni naładowanej baterii przed podłączeniem branży motoryzacyjnej napięcia zasilania każdej komory wynosi od 2,5 do 2,7 V. Gdy zostanie podłączone obciążenie, napięcie szybko spada do około 2,1 V, trzy lub cztery minuty. Wynika to z tworzenia cienkiej warstwy siarczanu ołowiu na powierzchni płyt ujemnych elektrod i pomiędzy nimi warstwy ołowiu i nadtlenku metalu płyt dodatnich. Ostateczna wartość napięcia komórek po sieci drogowej łączącej około 2,15-2,18 woltów.
Gdy prąd zaczyna płynąć przez baterię podczas pierwszej godziny pracy, występuje spadek napięcia do 2 V ze względu na zwiększoną odporność na ogniwa ze względu na powstawanie większych ilości siarczanu, który wypełnia pory płytek i selekcję kwasu elektrolitu. Krótko przed rozpoczęciem przepływu gęstości prądu w elektrolicie jest maksymalne i jest równa 1,300 g / cm3. Początkowo zbyt niskiego ciśnienia odbywa się szybko, ale następnie ustawić zrównoważony stan pomiędzy gęstością kwasu pobliżu płytki i zasadniczo elektrolitami elektrody selekcji objętość obsługiwane kwasu wprowadzanych nowego kwasu elementów z masy elektrolitu. Średnia gęstość elektrolitu nadal maleje stale w związku przedstawionym na rysunku. powyżej. Po początkowym spadku napięcia maleje wolniej, jego stopa redukcji zależy od obciążenia baterii. Proces czas rozładowania harmonogram jest pokazany na fig. poniżej. 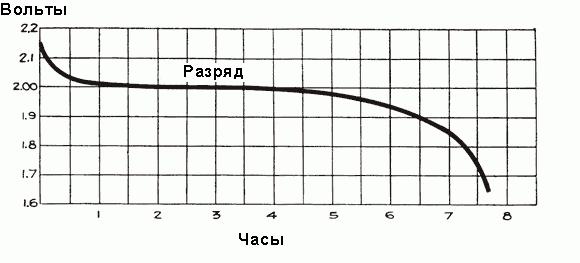
Kontrola stanu elektrolitu w akumulatorze
W celu określenia gęstościomierz gęstości użyty. Składa się ona z zamkniętej rurce szklanej z rozszerzeniem na dolnym końcu, wypełnioną rtęcią i strzał oraz stopniem skali na górnym końcu. Skala oznaczone od 1100 do 1300 z różnych wartości pośrednie, jak pokazano na fig. poniżej. Jeśli areometr jest umieszczony w elektrolicie, to opadają na pewnej głębokości. W ten sposób, że przemieszczenia pewnej objętości elektrolitu i po osiągnięciu stanu równowagi, masę wypartego objętość będzie po prostu równa areometr wagi. Ponieważ gęstość elektrolitu wynosi stosunek jego masy do objętości i masy hydrometru jest znana, wówczas każdy poziom zanurzenia w roztworze odpowiada zwłaszcza jego gęstości. 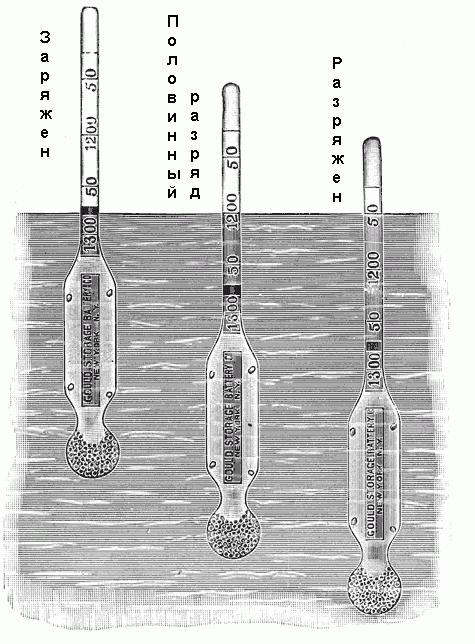 Niektóre densymetry mieć z wartościami skali gęstości, ale oznaczone są „naładowane”, „pół cyfra”, „rozładowywania” lub tym podobne.
Niektóre densymetry mieć z wartościami skali gęstości, ale oznaczone są „naładowane”, „pół cyfra”, „rozładowywania” lub tym podobne.

















