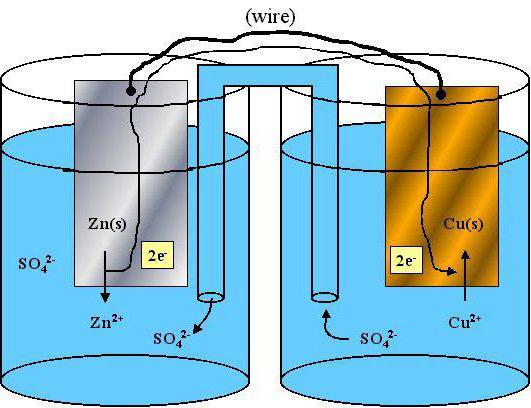
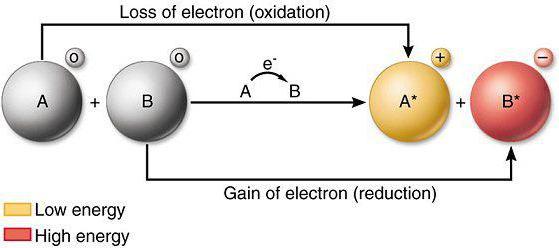
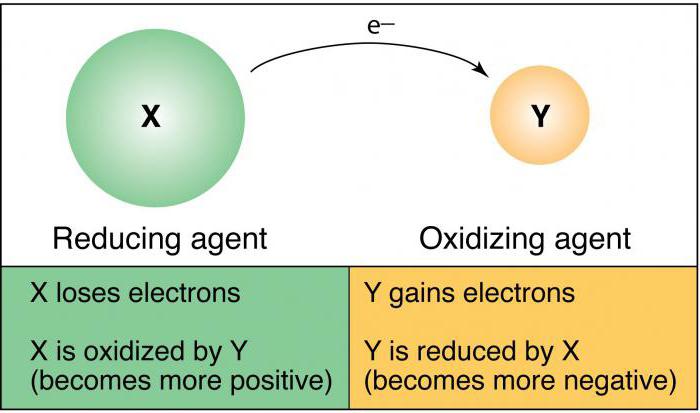
… właściwości redukujące mają właściwości redoks
właściwości redoks pojedynczych atomów i jonów są ważnym problemem w nowoczesnej chemii. Ten materiał pomaga wyjaśnić aktywności pierwiastków i substancji przeprowadzenie szczegółowego porównania właściwości chemicznych różnych atomów.

Co jest czynnikiem utleniającym
Wiele problemów w chemii, w tym pytań testowych ujednoliconego egzaminu państwowego w klasie 11 i JEG w 9 klasie, związanych z tym pojęciem. Utleniacz jest uważany atomów lub jonów, które w trakcie oddziaływania chemicznego akceptowania elektronów od innego atomu lub jonu. Jeśli przeanalizujemy właściwości utleniające atomów potrzebują układu okresowego Mendelejewa. W okresie, które znajdują się w tabeli, od lewej do prawej, ciwutleniające wzrasta węgla, to znaczy, mają podobne właściwości niemetaliczne. Główną podgrupy podobny parametr spada w dół. Wśród najbardziej wydajne prostych substancji mających zdolność utleniającą prowadzić fluor. Termin takie jak „elektroujemności”, to jest możliwe, aby atom w przypadku oddziaływania chemicznego elektronów może być za synonim właściwościach utleniających. Wśród substancji złożonych, które składają się z dwóch lub więcej pierwiastków można uznać jasne utleniaczy: nadmanganianu potasu, chloran potasu, ozon.

Jaki jest reduktorem
Zmniejszenie właściwości typowe dla atomów prostych substancji o właściwościach metalicznych. W okresach okresowego we właściwościach metalicznych, pozostawiono osłabiony i w dużych podgrup (pionowo), są wzmocnione. Istotą ożywienia oddziaływania elektronów, które znajdują się na zewnętrznym poziomie energii. Im większa liczba powłok elektronowych (poziomy), tym łatwiej podczas wysyłania interakcji chemicznej „dodatkowe” elektronów.
Doskonałe właściwości redukujące mają czynnych (środków alkalicznych, metali ziem alkalicznych), metale. Ponadto substancje wykazujące podobne parametry, które odróżniają tlenek siarki (6), tlenku węgla. W celu uzyskania wyższego stopnia utleniania, związki muszą wykazywać właściwości redukujące.
Proces utleniania
Jeżeli w wyniku oddziaływania chemicznego atomu lub jonu traci elektrony z innym atomem (jonów), odnosi się do procesu utleniania. Do analizy wpływu zmian właściwości i potencjału oksydacyjnego redukujące, wymaganych elementów układu okresowego, a także znajomość aktualnych przepisów prawa fizyki.

proces odzyskiwania
Procesy redukcji obejmują wprowadzenie jonów i elektronów atomów innych atomów (jony) podczas bezpośredniej reakcji chemicznej. Doskonałymi środkami redukującymi są azotany, siarczyny metali alkalicznych. Zmniejszenie właściwości elementów systemu zmieniającego właściwości metalu podobnych prostych substancji.
Algorytm analizy OVR
W celu gotowej reakcji chemicznej studenta do ustalenia współczynników, należy użyć specjalnego algorytmu. właściwości redoks pomaga rozwiązać wiele zadań projektowych w analitycznej, organicznej chemii ogólnej. Zamówienie oferują żadnej analizy reakcji:
- Po pierwsze, ważne jest, aby określić stan każdego elementu dostępny na utlenianie, za pomocą reguł.
- Następnie określmy te atomy lub jony, które zmieniły swój stopień utlenienia brać udział w reakcji.
- Znaki „minus” i „plus” oznaczają liczbę oddanych przyjętym podczas reakcji chemicznej wolnych elektronów.
- Ponadto, pomiędzy ilością elektronów jest określana przez minimalną wspólna wielokrotność, to jest liczbą całkowitą wielokrotnością liczby akceptowanych i poddali elektronów.
- Następnie dzieli się elektronów udział w reakcjach chemicznych.
- Następnie możemy dokładnie określić, której jony lub atomy posiadają właściwości redukujące, jak również określenia utleniaczy.
- W końcowym etapie współczynników stanowią w równaniu.
Stosując metodę bilansu elektronicznej, aby umieścić współczynniki w danym schemacie reakcji:
NaMnO 4 + Kwas siarkowy + siarkowodoru Mn = S + SO 4 + … + …
Algorytm rozwiązania tego problemu
Dowiemy się dokładnie to, co powinno być utworzone po interakcji materii. Ponieważ reakcja jest już utleniacza (będą manganu) i określony środek redukujący (będzie siarki) tworzy substancja, która nie zmienia się stopień utlenienia. Ponieważ Główna reakcja zachodzi między solą i silnym kwasem zawierającym tlen, a jedno z substancji końcowy będzie woda, a drugi – sól sodowa, dokładniej, siarczan sodu.
Wróćmy teraz schemat oraz przyjęcie elektronu:
– MN +7 trwa 5 E Mn +2.
Druga część programu:
– S = S -2 0 otdaet2e
Włożony w początkowych szybkości reakcji, nie zapominając Podsumowując wszystkie atomy siarki na stronach równania.
2NaMnO 4 + 5 H 2 S + 3 H 2SO 4 = 5S + 2MnSO 4 + 8H 2O + Na2 SO4.
Parsowanie OVR udziałem nadtlenku wodoru
Stosując OVR analizy algorytm może równać się reakcję chemiczną:
nadtlenek wodoru + Kwas siarkowy + potasu permagnanat Mn + 4 tak tlen + … + …
Utlenianie jonu zmienione tlenu (nadtlenek wodoru) i kation manganu nadmanganianu potasu. Oznacza to, że środek redukujący i środek utleniający, jesteśmy obecni.
Określić, co materiał może jeszcze zdarzyć po interakcji. Jednym z nich jest woda, która jest oczywiście reprezentowane przez reakcję pomiędzy kwasem i solą. Potasu nie tworzą nową substancję, drugi produkt potasowych soli, a mianowicie siarczanu, w miarę postępów reakcji z kwasem siarkowym.
jazdy:
2O – 2 daje elektronów i przekształcony O 2 0 5
Mn +7 5 odbiera elektrony i staje się jon 2 Mn + 2
Kładziemy ceny.
5H 2O 2 + 3 H 2SO 4 + 2KMnO = 5O 2 4 + + SO4 2Mn 8H 2O + K 2SO 4
Przykład przetwarzania OVR z chromianu potasu
Stosując metodę wagi elektronicznej, ustanawia równanie współczynniki:
FeCl2 + Kwas chlorowodorowy + potasu chromianu = FeCl3 CrCl 3 + + … + …
Zmieniony stan utlenienia żelaza (chlorek żelaza w etapie II) oraz jon chromu z dwuchromianu potasu.
Teraz staramy się zorientować się, jakie inne substancje powstają. Ktoś może być sól. Potas nie tworzy się każdy związek ten sposób drugi produkt jest sól potasowa, a dokładniej, chlorek, ponieważ prowadzi się reakcję z kwasem solnym.
Do wykresu:
Fe + 2 e = wysyła Fe + 3 6 redukującego
2Cr + 6 6 odbiera e = 2Cr +3 1 utleniacza.
Stawiamy współczynniki w początkowej reakcji:
6K 2 Kr 2O 7 + FeCl2 + 14HCl = 7H 2O + 6FeCl 3 + 3 + 2KCL 2CrCl
Przykład przetwarzania OVR jodkiem potasu
Uzbrojony z przepisami, ustalenia równania:
Nadmanganian potasu + Kwas siarkowy + jodek potasu, siarczan manganu jodo + … + … + …
stan utlenienia zmienił mangan i jod. To jest reduktor i utleniacz są obecne.
Teraz dowiadujemy się, w końcu mamy założony. Związek będzie miał potasu, to znaczy uzyskania siarczanu potasu.
Procesy redukcja zachodzą w tym jonów jodu.
Postać systemu przenoszenia elektronów:
– MN +7 5 odbiera e Mn + 2 2 czynnik utleniający
– 2I – daje Ile = I 2 2 0 5 jest środek redukujący.
My rozmieścić współczynniki w początkowej reakcji, a nie zapomni Podsumowując wszystkie atomy siarki w równaniu.
210KI + KMnO 4 + 8H 2SO 4 = 2MnSO 5I 2 4 + + 6K 2SO 4 + 8H 2O
Przykład przetwarzania OVR siarczynem sodowym
Za pomocą klasycznej metody, zwracamy się systemy do równania:
– Kwas siarkowy + + … KMnO 4 siarczyn sodu, siarczan sodu, siarczan manganu + … + … +
Po reakcji otrzymania soli wodę sodową.
Do wykresu:
– MN +7 5 odbiera e Mn + 2 2
– S +4 2 wysyła E = S +6 +5.
My rozmieścić współczynniki w tej reakcji nie zapomni umieścić atomy siarki w tworzeniu współczynników.
3 H 2SO 4 + 4 + 2KMnO 5NA 2 SO3 = K 2SO 4 + 4 + 2MnSO 5NA 2SO 4 + 3H 2O
Przykład przetwarzania OVR azotem
Wykonaj następujące zadania. Przy użyciu algorytmu, że tworzą kompletną równania reakcji:
– azotanu manganu + Kwas azotowy PbO + 2 = HMnO 4 + Pb (NO 3) 2 +
Przeanalizujmy jakie substancja nawet formy. Ponieważ reakcję utrzymywano pomiędzy silnego środka utleniającego i soli, po czym substancja jest woda.
Pokażemy zmianę liczby elektronów:
– Mn + 2 5 wysyła e Mn +7 2 wykazuje właściwości środka redukującego
– Pb +4 2 otrzymuje e = Pb + 2 5 utleniacza.
3. rozmieścić współczynniki w początkowej reakcji, ostrożnie dodać wszystkie azotu zawartego w lewej części początkowej równania:
– 2Mn (NO 3) 2 + 3 + 6HNO 5PbO 2 = 2HMnO 4 + 5PB (NO 3) 2 + 2H 2O
W tej reakcji, właściwości redukujące nie manifestują się azot.
Druga próbka reakcji redoks azotu:
Zn + Kwas siarkowy + HNO3 = ZnSO 4 + NO + …
– Zn 0 2 wysyła E = Zn + 2 3 jest środek redukujący
N + 5 3 otrzymuje e = N + 2 2 utleniacz.
Umieszczamy współczynników określonej równaniem
3Zn + 3 H 2SO 4 + 3 = 2HNO 3ZnSO 4 + 2NO + 4H 2O
Istotność reakcji redoks
Najbardziej znaną reakcję redukcji – fotosynteza, typowy roślin. Jak zmienić właściwości odzysku? Proces ten zachodzi w biosferze, prowadzi to do wzrostu energii z zewnętrznego źródła. Jest to energia i wykorzystuje dla swoich potrzeb ludzkości. Przykładowe utleniające i zmniejszania niepożądanych związanych z pierwiastków, mają szczególne znaczenie dla konwersji związków azotu, dwutlenku węgla, tlenu. W procesie fotosyntezy atmosfera Ziemi ma taki skład, który jest wymagany dla rozwoju organizmów żywych. Poprzez zwiększenie fotosyntezy nie dwutlenek węgla w osłonie powietrza, powierzchni ziemi nie jest przegrzana. Roślina rozwija się nie tylko w reakcji redoks, ale pożądane kształty, na przykład dla ludzi substancje, takie jak tlen, glukozę. Bez tej reakcji chemicznej nie może być pełny cykl materii w naturze, jak i obecność organicznego życia.
Praktyczne zastosowanie OVR
W celu utrzymywania powierzchni metalu, konieczne jest, aby wiedzieć, że mają właściwości zmniejszania aktywne metale, a zatem możliwe jest pokrycie warstwy powierzchniowej w stosunku do składnika aktywnego, a tym samym spowalnia proces korozji chemicznej. Ze względu na właściwości redoks za pomocą czyszczenia i dezynfekcji wody pitnej. Żaden z nich problemu nie można rozwiązać bez prawidłowo umieszczony w współczynników równania. W celu uniknięcia błędów, ważne jest, aby mieć wyobrażenie o wszystkich parametrów redoks.
Ochrona przed korozją chemiczną
Szczególnym wyzwaniem dla ludzkiego życia i aktywności jest korozja. W wyniku przemiany chemicznej awarii metalu, tracąc wydajności części samochodowych, obrabiarek. W celu wyeliminowania tego problemu, przy użyciu ochrony protektorowej, warstwa powłoki metalicznej lakieru lub farby stosowania stopów antykorozyjnymi. Na przykład, powierzchnia stalowa jest pokryta warstwą metalu aktywnego – z aluminium.
wniosek
Różnorodne reakcje redukcji występują w organizmie, zapewnia prawidłowe funkcjonowanie przewodu pokarmowego. Takie podstawowe procesy życiowe jak fermentacja, gniciem, oddychanie, również z właściwości redukujące. Mają podobne funkcje, wszystkie żyjące istoty na naszej planecie. Bez reakcji z zaangażowaniem i akceptacji elektronów nie można górnictwo, przemysłowej produkcji amoniaku, zasad, kwasów. We wszystkich technik chemii analitycznej analiza objętościowa opiera się na procesach redoks. Walczyć z takim nieprzyjemnego zjawiska korozji chemicznej, to również opiera się na wiedzy o tych procesach.