Związki kompleksowe: nomenklatura i klasyfikacja
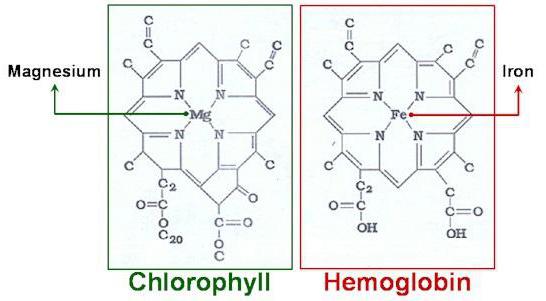
Największa i najbardziej zróżnicowany spośród materiałów nieorganicznych jest klasa związków kompleksowych. W tym celu mogą być przypisane do grupy obejmującej związki metaloorganiczne, takie jak chlorofil i hemoglobiny. To właśnie te połączenia są pomostem, który łączy chemii nieorganicznej i organicznej w zunifikowanej nauki. Nieocenione rolę w rozwoju wiedzy złożone materiały w dziedzinie chemii analitycznej i chemii kryształu, badanie najbardziej ważnych procesach biologicznych: fotosynteza, wewnętrzne (komórkowych) oddychanie.
W tym artykule będziemy badać strukturę i nazewnictwo związków kompleksowych, jak również podstawowe zasady ich klasyfikacji.
Teoria koordynacja A. Werner
Na koniec XX szwajcarski naukowiec A. Werner okazało się, że cząsteczka w każdej złożonej substancji kilka konstrukcji, które zostały nazwane, odpowiednio, centralny jon ligandy (ligandów) a zewnętrzną sfery koordynacyjnej. Że były jasne klasyfikacji i nomenklatura związków kompleksowych, że wyjaśnienie tych pojęć w sposób bardziej szczegółowy. Tak więc, A. Werner udowodniono w obecności jonów (zwykle cząsteczkę dodatnio naładowana), zajmującej centralne położenie. Stał się znany jako środek kompleksotwórczy, centralny jon lub atom. może on być umieszczony w pobliżu tak zwanych obojętnych cząsteczek ligandów i ujemnie naładowanych cząstek aniony, które tworzą wewnętrzną sferę koordynacyjną materiału. Wszystkie pozostałe cząstki, które nie weszły do niego, tworząc osłonę zewnętrzną w cząsteczce.
Zatem we wzorze kupryt sodu Na2 [Cu (OH) 4], centralny atom miedź w stanie utlenienia +2 i cztery gidroksogrupp stanowią wewnętrzną sferę, natomiast jony sodowe są umieszczone w pewnej odległości od centralnego atomu w zewnętrznej kuli.
Metody określania ogniskowe wzory i nazwy substancji
Do tej pory teoria A. Werner jest główną podstawą teoretyczną, na której studiuje złożonych kompleksów. Nomenklatura, czyli nazwy tych substancji są określane zgodnie z przepisami przyjętymi przez Międzynarodowe Towarzystwo Teoretycznej i Stosowanej Chemii.
Dać szereg przykładów preparatów substancji, która zawiera atom platyny kompleksujący – k2 [PtCI 6] lub cząsteczek NH3 – [Ag (NH3) 2] CI. Jak się okazało, wzór może być uzyskane za pomocą następujących rozwiązań: reakcje podwójnej wymiany, molową przewodnością roztworów rentgenowską metodą dyfrakcyjną. Uważają, że te metody w szczegółach.
Jak pokazano strukturę związki kompleksowe platyny
Substancje z tej grupy charakteryzują się obecnością w cząsteczce centralnego atomu platyny. Gdy związek PtCI4 x 6NH 3 czyn roztwór azotanu srebra, następnie cały chlor obecny w materiale związanym z atomami metali i AgCl utworzyły się białe płatki. Oznacza to, że wszystkie aniony chloru w sferze koordynacyjnej zewnętrznej, podczas gdy cząsteczki amoniaku były związane z atomem centralnym platyny i razem z nim tworzy wewnętrzną kuli.
oznacza to, że związek koordynacyjny o wzorze rejestruje się w tej postaci: [Pt (NH3) 6] CI 4 i nazywane chlorek platyny hexammine. Za pomocą metody dyfrakcji rentgenowskiej, chemicy zbadane i innych związków, które w nomenklaturze złożone zostaną zainstalowane w następnej sekcji.
Krystaliczne związki chromu
Konstrukcja tej grupy substancji zidentyfikowano przez fizyczne procesu rentgenowskiej dyfrakcji leżącej rentgenowskiej analizy dyfrakcyjnej. Przechodząc przez sieci krystalicznej, fala elektromagnetyczna rozproszone poprzez działanie elektronów substancji badanej. W ten sposób można bardzo dokładnie ustalić, które grupy atomów są w miejscach sieci krystalicznej. odpowiadającej nomenklatura związków kompleksowych został stworzony w celu kryształów zawierających chrom. Przykłady nazw izomeryczne hydraty soli trójwartościowego chromu, opracowanych przez metody dyfrakcji promieniowania rentgenowskiego, są następujące: chlorek tetraakvadihlorohroma (III), chlorek pentaakvahlorohroma (III).
Stwierdzono, że w tych materiałach atom chromu związany sześć różnych ligandów. W jaki sposób można określić szybkość i każdy czynnik wpływa na liczbę koordynacyjną?
Jako atom centralny jest związany z ligandami
Aby odpowiedzieć na pytania postawione powyżej, warto przypomnieć, że w bezpośrednim sąsiedztwie środka kompleksującego kilka struktury, zwane ligandami, albo ligandy. Ich liczba oddanych i określa liczbę koordynacyjną. Według teorii, A., Werner, klasyfikacji i odbioru nomenklatury związków kompleksowych są bezpośrednio zależne od tego wskaźnika. Jest to związane z utlenianiem współzależnie z atomu centralnego. W związkach platyny, chromu, żelaza z liczbą koordynacyjną równą najbardziej do sześciu; Jeśli środek kompleksujący jest reprezentowane przez atomy miedzi i cynku – cztery, jeżeli atom centralny jest srebro lub miedź – dwa.
Rodzaje związków kompleksowych
W chemii, wyróżnia jako głównych klas i szeregach substancji przejściowych między nimi. Omówione w poprzednich związkach kompleksowych, które podsumowania nomenklatura wskazuje na obecność w ich strukturze cząsteczki wody aquacomplexes. Przez ammine obejmują substancje zawierające amoniak obojętnych cząstek, takich jak trójjodo triamminrody. Swoisty struktura cząsteczkowa klasy związków chelatujących. Ich nazwa pochodzi od biologicznego terminu Szczękoczułki – tzw pazur decapod. Substancje te zawierają ligand, konfigurację przestrzenną, która zawiera środek kompleksotwórczy, pazurami. Takie związki obejmują kompleks żelazowy szczawiany, etilendiamminovy kompleksu platyny o stopniu utlenienia +4, sole kwasu aminooctowego, które zawierają jony rodu, platyny lub miedzi.

Zasady sporządzania nazwy związków kompleksowych
Najczęstszym pytaniem testu w dążeniu do chemii w trakcie liceum to: zadzwoń skomplikowany związek nomenklatury IUPAC. W konkretnym przykładzie, algorytm analizy zestawiania tytułowy substancje o następującym wzorze: (NH 4) 2, [Pt (OH) 2 Cl 4].
- Nazwa zaczyna się od ustalenia składu wewnętrznej sferze koordynacyjnej. zawiera grup hydroksylowych i aniony chloru. Tytuły te dodać -o końcowego. Otrzymujemy digidrokso-, tetrahloro-.
- Teraz znajdujemy środek kompleksujący wykorzystaniem jego notacji nazwę łacińską, a także dodać do niej w -AT przyrostkiem w nawiasach wskazują jego stopień utlenienia: platinate (IV).
- Wykończona wewnętrznej symbol kuli, przesunąć na zewnątrz. Nazywamy to kation: w tym przykładzie są jony amonowe.
W rezultacie, substancja ma nazwę, w którym wszystkie wymienione wyżej struktury.
Zastosowanie związków kompleksowych
Na początku tego artykułu nazwaliśmy najważniejszych przedstawicieli substancji metaloorganicznych, takich jak hemoglobina, chlorofil, witaminy. Odgrywają one kluczową rolę w metabolizmie. Szeroko stosowane związki kompleksowe w cyklu technologicznego topienia metali żelaznych i nieżelaznych. Istotną rolę odgrywają w karbonylki metalurgii – specyficzne związki, które w nomenklaturze kompleksu wskazuje na obecność w cząsteczce z tlenkiem węgla CO, jako ligandem. Związki te ulegają rozkładowi pod metali ogrzewanie i zmniejszone takie jak nikiel, żelazo, kobalt z rudy. Większość kompleksów również stosować jako katalizatory w reakcjach produkcji lakierów, lakierów i tworzyw sztucznych.















