Tutaj czytelnik znajdzie informacje na temat halogenów, pierwiastków chemicznych w okresowym stole DI Mendeleviewa. Treść artykułu pozwoli Ci zapoznać się z ich właściwościami chemicznymi i fizycznymi, odkryć naturę, sposoby ich stosowania,
Informacje ogólne
Halogeny są wszystkimi elementami tabeli chemicznej DI Mendeleyev, zlokalizowanej w grupie siedemnastej. Przy bardziej rygorystycznej metodzie klasyfikacji są to wszystkie elementy siódmej grupy, głównej podgrupy.
Halogeny są elementami zdolnymi do reagowania z praktycznie wszystkimi substancjami prostego typu z wyjątkiem pewnej liczby niemetali. Wszystkie z nich są utleniaczami energetycznymi, dlatego w warunkach naturalnych z reguły są one w mieszanej formie z innymi substancjami. Indeks aktywności chemicznej halogenów maleje wraz ze wzrostem numeracji porządkowej.
Halogeny są następującymi pierwiastkami: fluor, chlor, brom, jod, aktyna i sztucznie wytworzony tennesses.
Jak stwierdzono wcześniej, wszystkie halogeny są utleniaczami o wyraźnych właściwościach, poza nimi wszystkie są niemetalami. Zewnętrzny poziom energii ma siedem elektronów. Interakcje z metalami prowadzą do powstania wiązań jonowych i soli. Prawie wszystkie halogeny, z wyjątkiem fluoru, mogą się objawiać jako czynnik redukujący, osiągając wyższy stopień oksydacyjny +7, ale w tym celu konieczne jest, aby oddziaływały one z elementami o większym stopniu elektroujemności.
Cechy etymologii

W 1841 r. Szwedzki chemik J. Berzelius zaproponował wprowadzenie terminu halogeny, powołując się na znane w tym czasie F, Br, I. Jednak przed wprowadzeniem tego terminu w odniesieniu do całej grupy takich pierwiastków, w 1811 r. Niemiecki naukowiec I Schweiger nazwał to samo słowo chlorem, termin ten został przetłumaczony z języka greckiego jako "sól".
Struktura atomowa i zdolności utleniające
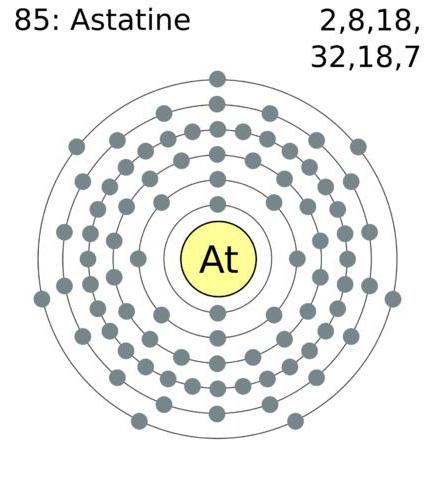
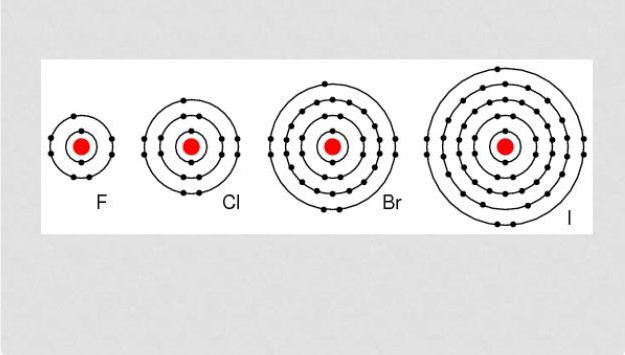
Konfiguracja elektronów zewnętrznej powłoki atomowej halogenów ma następującą postać: astat – 6s 2 6p 5 , jod – 5s 2 5p 5 , brom 4s 2 4 p 5 , chlor – 3 s 2 3 p 5 , fluor 2 s 2 2 p 5 .
Halogeny są elementami, które mają siedem elektronów na osłonie elektronów typu zewnętrznego, co pozwala im "bez wysiłku" przyłączyć elektron, który nie wystarcza do ukończenia powłoki. Zwykle stan utleniania jest wyrażony jako -1. Cl, Br, I i W reakcji na elementy o wyższym stopniu, wykazują dodatni stopień utlenienia: +1, +3, +5, +7. Fluor ma stały stopień utleniania -1.
Rozpowszechnianie
Ze względu na wysoki stopień reaktywności, halogeny mają zwykle postać związków. Poziom propagacji w skorupie Ziemi zmniejsza się wraz ze wzrostem promienia atomu od F do I. Astat w skorupie ziemskiej jest mierzony w gramach, a dziesięć są sztucznie tworzone.
Halogeny występują w naturze najczęściej w związkach halogenkowych, a jod może przybierać postać jodanu potasu lub sodu. Ze względu na ich rozpuszczalność w wodzie, są one obecne w wodach oceanicznych i solankach pochodzenia naturalnego. F jest nierozpuszczalnym przedstawicielem halogenów i najczęściej występuje w skałach osadowych, a głównym źródłem jest fluorek wapnia.
Fizyczne właściwości jakościowe
Halogeny między sobą mogą być bardzo różne i mają następujące właściwości fizyczne:
- Fluor (F2) to gaz o jasno żółtym zabarwieniu, ma ostry i drażniący zapach oraz nie ulega kompresji w normalnych warunkach temperaturowych. Temperatura topnienia wynosi -220 ° C, a temperatura wrzenia -188 ° C
- Chlor (Cl2) to gaz, który nie kurczy się w normalnych temperaturach, nawet jeśli jest wystawiony na działanie ciśnienia, ma zapachowy, ostry zapach i kolor zielony-żółty. Rozpuszczanie rozpoczyna się w temperaturze -101 ° C i sprowadza się do temperatury -34 ° C.
- Brom (Br 2 ) to lotna i ciężka ciecz o brązowo-brązowej barwie i o ostrym zapachu. Rozpuszcza się w temperaturze -7 ° C, gotuje się w temperaturze 58 ° C.
- Jod (I 2 ) – ta substancja stała ma ciemno szary kolor i ma metaliczny połysk, zapach jest dość ostry. Proces topienia rozpoczyna się w temperaturze 113,5 ° C i gotuje w 184,8585 ° C.
- Rzadkim halogenem jest astat (At 2 ), który jest ciało stałe i ma czarny i niebieski kolor z metalicznym połyskiem. Temperatura topnienia odpowiada temperaturze 244 ° C, a wrzenie rozpoczyna się po osiągnięciu temperatury 309 ° C.
Chemiczny charakter halogenów
Halogeny są elementami o bardzo wysokiej aktywności oksydacyjnej, które osłabiają się w kierunku od F do At. Fluor, będąc najbardziej aktywnym przedstawicielem halogenów, może reagować ze wszystkimi rodzajami metali, nie wykluczając żadnego znanego. Większość przedstawicieli metali, wchodzących w atmosferę fluoru, ulega samozapłonowi, a jednocześnie emituje ciepło w ogromnych ilościach.
Bez narażenia na działanie fluoru może reagować z dużą liczbą niemetali, na przykład H2, C, P, S, Si. Typ reakcji w tym przypadku jest egzotermiczny i może towarzyszyć wybuch. Po podgrzaniu, F wymusza pozostawanie halogenów do utleniania, a po napromieniowaniu ten element może reagować z ciężkimi gazami o obojętnym charakterze.
W kontakcie z substancjami o złożonym typie, fluor powoduje reakcje o wysokiej energii, na przykład przez utlenianie wody, może spowodować wybuch.

Chlor może być reaktywny, zwłaszcza w stanie wolnym. Poziom jego aktywności jest mniejszy niż fluoru, ale może reagować z prawie wszystkimi prostymi substancjami, ale gazy azotu, tlenu i szlachetnych nie reagują z nim. W kontakcie z wodorem, ogrzewaniem lub dobrym oświetleniem, chlor powoduje gwałtowną reakcję wraz z wybuchem.
Poza reakcjami substytucji, Cl może reagować z dużą liczbą substancji o złożonym charakterze. Jest w stanie zastąpić Br i I w wyniku nagrzania się związkami utworzonymi przez nich metalem lub wodorem i może również reagować z substancjami alkalicznymi.
Brom jest chemicznie mniej aktywny niż chlor lub fluor, ale nadal bardzo jaskrawo się manifestuje. Wynika to z faktu, że częściej brom Br stosuje się jako ciecz, ponieważ w tym stanie początkowe stężenie w innych identycznych warunkach jest wyższe niż początkowe stężenie Cl. Szeroko stosowany w chemii, zwłaszcza organicznej. Może rozpuszczać się w H2O i reagować z nim częściowo.
Jod halogenowy tworzy prostą substancję I2 i może reagować z H20, rozpuszcza się w jodkach roztworów tworząc złożone aniony. Z większości halogenów różni się tym, że nie reaguje z większością środków niemetalicznych i reaguje powoli na metale, podczas gdy musi być rozgrzany. Z wodorem reaguje, tylko pod silnym ogrzewaniem, a reakcja jest endotermiczna.
Rzadki halogen astat (At) wykazuje mniejszą reaktywność niż jod, ale może reagować z metalami. W wyniku dysocjacji powstają aniony i kationy.
Aplikacje
Związki halogenów są szeroko stosowane przez człowieka w szerokim zakresie dziedzin. Do wytworzenia Al stosuje się naturalny kryolit (Na3AlF6). Brom i jod są często stosowane przez firmy farmaceutyczne i chemiczne jako proste substancje. W produkcji części zamiennych do samochodów często stosuje się chlorowce. Reflektory są jednym z tych szczegółów. Ważny jest wybór materiału na ten składnik maszyny, ponieważ światła nocują w nocy i są sposobem na wykrycie zarówno Ciebie, jak i innych kierowców. Jednym z najlepszych materiałów kompozytowych do kreowania reflektorów jest ksenon. Halogen jest jednak gorszy od jakości tego gazu obojętnego.

Dobrym halogenem jest fluor, dodatek powszechnie stosowany w produkcji past do zębów. Pomaga zapobiegać pojawieniu się choroby zębowej – próchnicy.
Taki element halogenowy jak chlor (Cl), znajduje zastosowanie w produkcji HCl, jest często stosowany w syntezie substancji organicznych takich jak plastik, kauczuk, włókna syntetyczne, barwniki i rozpuszczalniki itd. Jako związki bielące stosuje się związki chloru Materiał lniany i bawełniany, papier i jako środek do zwalczania bakterii w wodzie pitnej.

Uwaga! Toksyczny!
Ze względu na bardzo wysoką reaktywność, halogeny są słusznie nazywane trującymi. Najwyraźniej możliwość włączenia się w reakcję wyraża się w fluorach. Halogeny mają wyraźne właściwości duszące i mogą oddziaływać na tkanki podczas interakcji.
Fluorina w oparach i aerozoli jest uważana za jedną z najbardziej potencjalnie niebezpiecznych form halogenów, szkodliwych dla otaczających żyjących rzeczy. Wynika to z faktu, że jest słabo postrzegany przez zmysł zapachu i odczuwa się dopiero po osiągnięciu wysokiego stężenia.
Podsumowując
Jak widać, halogeny są bardzo ważną częścią okresowego stołu Mendelejewa, posiadają wiele właściwości, różnią się właściwościami fizycznymi i chemicznymi, strukturą atomową, stopniem utleniania i zdolnością do reagowania z metalami i niemetalami. W przemyśle są one wykorzystywane na różne sposoby, od dodatków do środków higieny osobistej do syntezy organicznych substancji chemicznych lub bielonych. Pomimo faktu, że jednym z najlepszych sposobów na utrzymanie i stworzenie światła w świetle reflektorów samochodu jest ksenon, halogen jest praktycznie nie gorszy od niego, jest również powszechnie używany i ma swoje zalety.
Teraz wiesz, co to jest halogen. Skanvord z pytaniami dotyczącymi tych substancji dla Ciebie nie jest już przeszkodą.