Wiele reakcji podstawienia otwiera drogę do wytwarzania różnych związków posiadających stosowania narzędzia. Ogromną rolę w nauce i przemyśle chemicznym podano elektrofilowe i nukleofilowe podstawienie. W syntezie organicznej, procesy te mają kilka zalet, należy zwrócić uwagę.
Różnorodność zjawisk chemicznych. reakcji podstawienia
Zmiany chemiczne związane z transformacją materii, wiele różnych funkcji. Wyniki mogą być różne, efekty cieplne; niektóre procesy idą do końca, chodzi w drugiej równowagi chemicznej. środki modyfikujące często towarzyszy zwiększanie lub zmniejszanie stopnia utlenienia. W klasyfikacji zjawisk chemicznych w ich ostatecznych wyników zwraca uwagę na jakościowe i ilościowe różnice pomiędzy reagentami produkty. Cechy te można wydzielić 7 typów reakcji chemicznych, w tym substytucji, postępując zgodnie ze schematem: A-B-C, A + C + B. uproszczony zapis całej klasy zjawisk chemicznej stanowi pomysł, że wśród substancji wyjściowych tak zwanych „atakujący „podstawnik cząstek w atomu odczynnika jonowej grupy funkcyjnej. Reakcja podstawienia jest charakterystyczny nasyconych i aromatycznych węglowodorów.
reakcji podstawienia mogą występować w postaci podwójnej wymiany: A-B-C, C + + E A-B-E. Jeden podgatunek – przemieszczenie, na przykład z miedzi, żelaza z roztworu siarczanu miedzi: CUSO4 + Fe = l FeSO 4 + Cu. Jako „Atak” cząstki mogą działać jonów atomów lub grup funkcyjnych
Homolytic podstawienie (rodnikiem SR)
Gdy mechanizm rodnika pary pęknięcie kowalencyjne elektronów jest wspólny dla różnych elementów będzie proporcjonalnie pomiędzy „fragmenty” cząsteczki. Tworzenie się wolnych rodników. Ten niestabilny stabilizacja cząstek, które występuje w wyniku następnych reakcji. Na przykład, w przygotowaniu etanu z metanu wytwarzać wolne rodniki, biorące udział w reakcji podstawienia: CH4 CH3 • + • H; CH3 • + • CH3 → C2H5; H • + • H → H2. Homolytic rozerwanie wiązania na mechanizmie roboczym podstawienia charakterystyczne alkanów, reakcja ma postać łańcucha. Metan atomy H mogą być stopniowo zastępowane przez chlor. Podobnie jak w przypadku reakcji z bromu, jodu, ale nie jest w stanie bezpośrednio zastąpić alkany, wodór, fluor reaguje zbyt intensywnie z nich.
Sposób rozszczepiania wiązania heterolitycznego
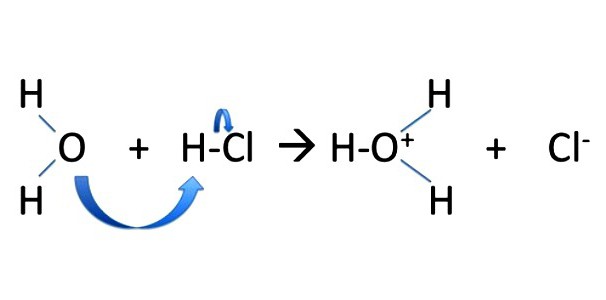
Gdy mechanizm reakcji podstawienia przepływu jonów, elektrony są nierównomiernie rozłożone pomiędzy cząstkami nowo powstały. Wiążącej się pary elektronów rozciąga się aż do jednego z „fragmenty”, najczęściej do partnera komunikacji, z boku, który nie przesunięciem negatywny gęstość w cząsteczce polarnego. Przez reakcje podstawienia obejmuje reakcję tworzenia alkoholu metylowego CH3OH. W brommetane cząsteczka ma postać szczeliny CH3Br heterolitycznego, naładowane cząstki są stabilne. Metylu uzyskuje ładunek dodatni i ujemny bromo -: CH3 Br → CH3 + Br -; NaOH → Na + OH -; CH 3 + OH – → CH3OH; Na + Br – ↔ NaBr.

Elektrofilne i nukleofile
Cząstki, które nie posiadają elektrony i może je przyjąć, nazywane są „elektrofilne”. Te atomy węgla związane z halogenów w halogenoalkanów. Nukleofile, ma dużą gęstość elektronową, są „ofiarami” pary elektronów do utworzenia wiązania kowalencyjnego. Reakcje podstawienia bogate ujemne ładunki są atakowane przez nukleofile elektrofilami, deficytem elektronów. Zjawisko to jest związane z ruchem węgla lub innych cząstek – grupę opuszczającą. Kolejna odmiana reakcji podstawienia – atakują elektrofilu nukleofil. Czasami trudno odróżnić pomiędzy tymi dwoma procesami, w odniesieniu do zastąpienia jednego lub drugiego rodzaju, ponieważ trudno jest dokładnie określić, jaki rodzaj cząsteczki – podłoże, a które – z odczynnikiem. Zazwyczaj w takich przypadkach, następujące czynniki są uważane:
- charakter grupę opuszczającą;
- reaktywności nukleofila;
- charakteru rozpuszczalnika;
- część alkilowa struktury.
Nukleofilowe podstawienie (SN)
W procesie interakcji w związku organicznego wzrasta polaryzacji. W równaniach częściową opłatą dodatniego lub ujemnego jest oznaczone literą greckiego alfabetu. komunikacja polaryzacja daje wskazanie charakteru jego pęknięcia i przyszłego zachowania „fragmenty” cząsteczki. Na przykład, atom węgla w jodometanie ma częściowy ładunek dodatni, to jest centrum elektrofilowe. Przyciąga dipol wody, w której tlen ma nadmiar elektronów. W reakcji elektrofila z nukleofilem jest utworzony metanol: CH3 I + H2O → CH3OH + HI. Reakcje nukleofilowego podstawienia ma miejsce, z udziałem ujemnie naładowanego jonu lub cząsteczki z wolną parą elektronów, które nie bierze udziału w tworzeniu wiązania chemicznego. Czynny udział jodometanu SN 2 reakcji ze względu na otwarcie na atak nukleofilowy i mobilności jodu.
Elektrofilowego podstawienia (SE)
Cząsteczka organiczna może być obecne centrum nukleofilowe, który charakteryzuje się nadmiarem gęstości elektronowej. Reaguje z brakiem ujemnych ładunków odczynnikiem elektrofilowym. Takie cząstki węgla posiadające wolne cząsteczki orbitalnej porcjami zmniejszonej gęstości elektronowej. Mrówczan sodu węgla kierująca „-”, poddaje się reakcji z dodatnią część dipola wody – wodór: CH3 Na + H2O → CH4 + NaOH. Produkt tej reakcji, elektrofilowego podstawienia – metanu. Gdy reakcje heterolitycznego oddziałują przeciwnie naładowanego ośrodków organicznych cząsteczek, co nadaje im powinowactwo do jonów nieorganicznych substancji chemicznych. Nie należy zapominać, że przekształcenie związków organicznych rzadko towarzyszy powstawanie tych kationów i anionów.
Jednocząsteczkową i reakcje dwucząsteczkowych
Nukleofilowe podstawienie jest błoną jednocząsteczkową (SN1). Przez taki mechanizm występuje ważny produkt hydrolizy syntezy organicznej – trzeciorzędowy chlorek butylu. Pierwszym etapem jest powolne, to związane jest z postępującymi dysocjacji w karboniowy kationu i anionu chlorkowego. Drugi etap to reakcja zachodzi szybciej jon karboniowy i wodę. Równanie reakcji podstawienia jak atom fluorowca, w celu uzyskania alkanu hydroksylową i alkoholu pierwszorzędowego (CH 3) 3 C-Cl → (CH 3) 3 C + CI -; (CH 3) 3 C + H2O → (CH 3) 3 C-OH + H +. Na jednym etapie hydrolizy pierwotnych i wtórnych halogenki alkilowe charakteryzują wyniszczania węgla ze względu na halogenu i powstawania pary C-OH. Ten mechanizm podstawienie nukleofilowe dwucząsteczkowych (SN2).
Mechanizm podstawienia heterolitycznego
Mechanizm podstawienia obejmuje przenoszenie elektronów, tworzenie kompleksów pośrednich. Reakcja zachodzi szybciej, tym łatwiej jest typowe związki pośrednie do niej. Często proces ten będzie w kilku kierunkach jednocześnie. Zaletą zwykle otrzymuje sposób, w którym stosuje się cząstki, wymagające najmniejszym nakładem energii podczas jej formowania. Na przykład, obecność podwójnego wiązania zwiększa prawdopodobieństwo, kationu allilowego CH2 = CH-CH2 + CH3 w porównaniu do + jonów. Przyczyna leży w gęstości elektronowej wiązanie wielokrotne, co wpływa na delokalizacji ładunku dodatniego, rozrzuconymi po całej cząsteczki.
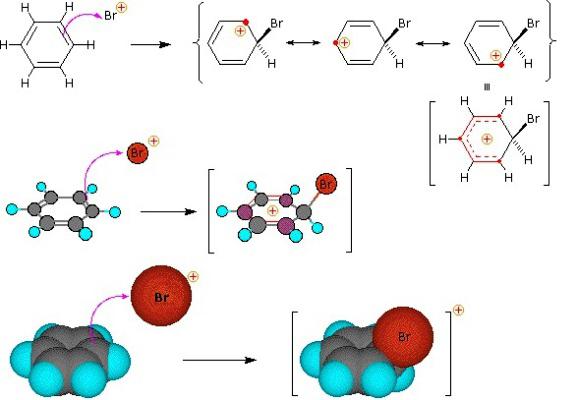
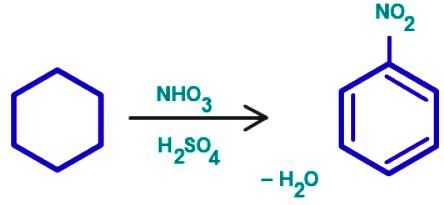
reakcji podstawienia benzen
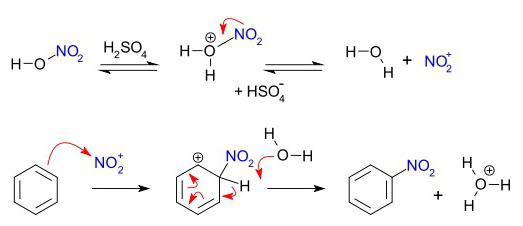
Grupa związków organicznych, które charakteryzują elektrofilowego podstawienia – areny. Benzen ring – wygodny obiekt dla elektro ataku. Proces rozpoczyna się komunikacji z drugim odczynnikiem polaryzacji, z wytworzeniem związku elektrofilowego chmura elektronów w sąsiedztwie pierścienia benzenowego. Rezultatem jest kompleks przejściowy. Cenne komunikacji cząstek elektrofilowych z jednym z atomów węgla, jeszcze nie jest przyciągany do całego ładunku ujemnym „aromatyczny sześcio” elektronów. W trzecim etapie procesu elektrofilem i jeden pierścieniowy atom węgla wiąże wspólną parę elektronów (wiązanie kowalencyjne). Ale w tym przypadku, to zniszczenie „aromatyczny sześcio”, co jest niekorzystne z punktu widzenia osiągnięcia stabilnego zrównoważonego stanu energetycznego. Jest to zjawisko, które można nazwać „uwolnienie protonu”. Dzieli się H +, odzyskuje się stabilny system komunikacyjny, typowe arenów. Substancja boczna zawiera kation wodoru w pierścieniu benzenowym i anionu z drugiego odczynnika.
Przykłady reakcji substytucji chemii organicznej
Do alkanów, zwłaszcza typowych reakcji podstawienia. Przykłady reakcji elektrofilowe i nukleofilowe mogą prowadzić do cykloalkanów i arenów. Podobne reakcje z cząsteczkami substancji organicznych, to w normalnych warunkach, lecz zwykle – i przez ogrzewanie w obecności katalizatorów. Przez typowe i dobrze badanych procesów obejmują elektrofilowego podstawienia aromatycznego. Najważniejszą reakcją tego typu:
- Nitrowania z benzenu z kwasem azotowym w obecności H 2SO 4 – następujący schemat: C 6H 6 → C 6H 5 -NO2.
- Chlorowcowanie katalityczny benzenu, zwłaszcza chlorowania równaniem: C 6H 6 + Cl2 → C 6H 5 Cl + HCI.
- Aromatyczne sulfonowanie wpływów benzenu „dymiący” kwas siarkowy wytwarzają się kwas benzenosulfonowy.
- Alkilowanie – zastąpienie atomu wodoru z pierścieniem benzenowym alkil.
- Acylowanie – powstawanie ciał ketonowych.
- Formylowanie – zastąpienia wodoru na grupie CHO i tworzenia aldehydów.
Przez reakcje podstawienia obejmuje reakcję w alkanów i cykloalkanów, przy czym halogeny atakują dostępne wiązania C-H. Derywatyzacja może być związane z wymianą jeden, dwa lub wszystkie atomy wodoru w węglowodory nasycone i cykloalkanów. Wiele galogenoalkanov o niskiej masie cząsteczkowej są używane do wytwarzania bardziej skomplikowanych substancjami należącymi do różnych klas. Korzyści osiąganych w badaniu mechanizmów reakcji podstawienia, daje silny bodziec dla opracowania syntez na bazie alkany, cyklo stadium i chlorowcowane węglowodory.














