Kompleks białko, oprócz samego składnika białkowego zawiera dodatkową grupę o różnym charakterze (protetycznego). Jako komponentu są węglowodany, lipidy, metale, reszt fosforowych kwasu, kwasu nukleinowego. Jaka jest różnica proste białka z kompleksu, na jakiego rodzaju podzielonych tych substancji, oraz jakie są ich cechy charakterystyczne, ten artykuł pokaże. Główną różnicą między substancjami w pytaniu – ich skład.
Białka kompleksu: definicja
Ten materiał dwuskładnikowy, który obejmuje łańcuchy proste białko (peptyd) i materiału niebiałkowego (grup prostetycznych). W procesie hydrolizy powstają aminokwasy, i część nie-proteinową produktów rozkładu. Jaka jest różnica proste białka z kompleksu? Pierwszy składa się wyłącznie z aminokwasów.
Klasyfikacja i charakterystyka białek kompleksujących
Substancje te są dzielone na typy w zależności od rodzaju dodatkowe grupy. Dla złożonych białek należą:
- – białko glikoproteiny, molekuły, które zawierają ugrupowania węglowodanowego. Wśród nich są proteoglikany (składniki przestrzeni międzykomórkowej), włącznie z jego mukopolisacharydów konstrukcji. Dla immunoglobulin są glikoproteiny.
- Lipoproteiny zawierają składnik lipidowy. Należą apolipoproteiny, pełniąc funkcję zapewnienia transportu lipidów.
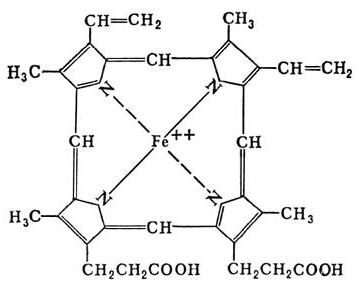
- Metaloproteiny zawiera jony metalu (miedzi, manganu, żelaza, itd.), Połączone poprzez oddziaływanie akceptora i donora. Ta grupa nie obejmuje białka zawierające hemu profirinovogo pierścienia związku z żelaza, i tym podobne w strukturze związku o wzorze (chlorofil, w szczególności).
- Nukleoproteiny – białka o niekowalencyjne wiązania z kwasów nukleinowych (DNA, RNA). Należą chromatyny – składnika chromosomów.
- 5. Fosfoproteidy, które obejmują kazeinę (kompleks skrzep białka) obejmują kowalencyjnie związanych reszt kwasu fosforowego.
- Chromoproteins zabarwienie łączy element protetyczny. Klasa ta obejmuje białka hemu, chlorofile i flawoprotein.
Cechy glikoprotein i proteoglikanów
Białka te są złożone substancje. Proteoglikany zawierają dużą część węglowodanów (80-85%) konwencjonalne glikoproteiny zawartość wynosi 15-20%. kwasy uronowe są obecne tylko w proteoglikanów cząsteczce, węglowodany różnią się regularnie powtarzającą się strukturę jednostki. Jaka jest struktura i funkcja złożonych białek, glikoprotein? Ich łańcuchy węglowodanowe zawierają tylko 15 jednostek i mają nieregularną strukturę. Struktury węglowodanowe komunikacji glikoprotein ze składnikiem białkowym jest zazwyczaj poprzez reszty aminokwasowe, takie jak seryna lub asparagina.

Funkcje glikoprotein:
- Są częścią ściany komórkowej bakterii, kości i tkanki łącznej chrząstki, kolagenu otaczają włókna elastyny.
- Odgrywać rolę ochronną. Na przykład, struktura ta ma przeciwciała, interferonów, czynników krzepnięcia krwi (protrombiny fibrynogen).
- Są receptory, które oddziałują z efektorem – mała cząsteczka nie-białkowym. Ostatni, łączenie białka prowadzi do zmiany jego konformacji, co prowadzi do konkretnej odpowiedzi wewnątrzkomórkowej.
- Wykonaj funkcję hormonalną. Odnosi się do glikoproteiny gonadotropiny, TSH oraz adrenokortykotropowy.
- Substancja transportowane we krwi i jonów przez błonę komórkową (transferyną transcortin, albumina, Na +, K + -ATP-azy).
Przez glikoproteiny zawierają enzymy cholinesterazy i nukleazy.
Więcej o proteoglikanów
Zazwyczaj proteoglikanu kompleks białkowy zawiera w swojej strukturze łańcuch węglowodanu z dużą powtarzania reszt disacharydowych złożonych z kwasu uronowego i aminocukru. Oligo- lub polisacharydy zwane łańcuchy glikanów. Pierwszy zwykle zawierają 2-10 jednostek monomerycznych.
W zależności od struktury łańcuchów węglowodanowych wydzielają ich różnych typów, na przykład, kwaśne heteropolisacharydy z więcej grup kwasowych lub glikozaminoglikanów zawierających grupy aminowe. Do tych ostatnich należą:
- kwas hialuronowy, który jest aktywnie wykorzystywany w kosmetyce.
- Heparyna, co zapobiega krzepnięciu krwi.
- Siarczan keratanu – składniki chrząstki i rogówki.
- siarczany chondroityny część chrząstki i płynu maziowego.
Te polimery – proteoglikanów składników, które wypełniają przestrzeń międzykomórkową, zatrzymanie wody, smarowanie części ruchomych stawów, to jego elementów konstrukcyjnych. Hydrofilowości (dobra rozpuszczalność w wodzie), proteoglikany umożliwia ich w przestrzeni międzykomórkowej, aby utworzyć barierę dla dużych cząsteczek i mikroorganizmów. Z ich pomocą utworzenia zżelowanej matrycy, w którym zanurzone włókna innych ważnych białek, takich jak kolagen. Jego zespoły proteoglikanów w środowisku mają kształt drzewa.
Funkcje i rodzaje lipoprotein
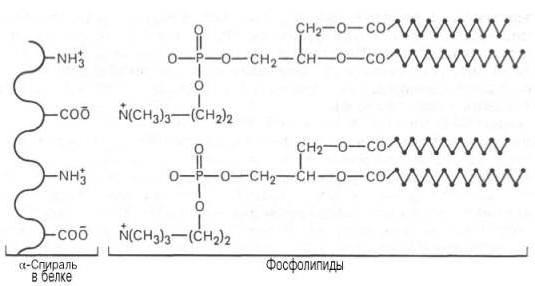
Lipoprotein kompleks białkowy ma także wyraźny podwójny charakter hydrofilowy i hydrofobowy. Cząsteczka rdzeń (część hydrofobowa) tworzą niepolarne estrów cholesterolu i triglicerydów.
Zewnątrz w strefie hydrofilowym rozmieszczone część białka, fosfolipidy, cholesterol. Istnieje kilka odmian lipoprotein białek w zależności od ich struktury.
Do głównych klas lipoprotein:
- Wyrafinowanych białek wysokiej gęstości (HDL, α-lipoproteina). Przenosi cholesterolu w wątrobie i tkankach obwodowych.
- O niskiej gęstości (LDL, p-lipoproteiny). Ponadto cholesterol transportowany jest triglicerydów i fosfolipidów.
- O bardzo małej gęstości (VLDL, wstępnie β lipoproteiny). Spełniają funkcję podobną do LDL.
- Chylomikrony (CM). Transportuje kwasy tłuszczowe i cholesterol z jelita po posiłku.
Patologii naczyniowych, takich jak miażdżyca tętnic, wynikających z nieprawidłowego proporcji różnych typów lipoprotein we krwi. Przez charakterystyki kompozycji można ujawniła szereg zmian struktury Trends fosfolipidami (z HDL do chylomikronów) zmniejszenie proporcji białka (od 80 do 10%) i fosfolipidy, triacylogliceryd procentowy wzrost (20 do 90%).
Wśród wielu ważnych enzymów, metaloproteinach
Metaloproteiny mogą zawierać różne jony metali. Ich obecność wpływa orientacji podłoża w miejscu aktywnym (katalityczny) enzymu. Jony metali znajdują się w miejscu aktywnym i odgrywają ważną rolę w reakcji katalitycznej. jonowego często działa jako akceptor elektronów.
Przykłady metali zawartych w strukturze metaloprotein enzymu:
- Miedź jest w oksydazy cytochromowej, który wraz z hemowa zawiera jony tego metalu. Enzym ten bierze udział w tworzeniu ATP w łańcuchu oddechowym.
- Żelaza zawierać enzymy, takie jak ferrytyny żelaza pełni funkcję nanoszące w komórce; transferyny – nośnik żelaza we krwi; Reakcję katalazy odpowiada za neutralizacji nadtlenku wodoru.
- Cynk – metalowej, która jest charakterystyczna dla alkoholu udział w utlenianiu etanol i podobne alkohole; dehydrogenaza mleczanowa – enzym w metabolizmie kwasu mlekowego; anhydraza węglanowa, która katalizuje tworzenie się kwasu karboksylowego z CO 2 i H 2O; fosfataza alkaliczna, wykonuje hydrolityczne rozszczepianie estrów fosforanowych z różnych związków; α2-makroglobulina – antiproteazny białko krwi.
- Selen jest częścią thyroperoxidase uczestniczenia w tworzeniu hormonów tarczycy; peroksydaza glutationowa, działając jako funkcji przeciwutleniacza.
- Wapń jest charakterystyczne dla struktury a-amylazy – enzym hydrolizujący skrobię rozszczepienia.
fosfoproteiną
Ta część kompleksu fosfoproteiny białka? Do tej kategorii charakteryzuje się obecnością grupy fosforanowe, które są połączone z ugrupowaniem białka poprzez aminokwasu z grupą hydroksylową (tyrozyny, seryny lub treoniny). Co kwasu fosforowego, natomiast w strukturze białka? Zmienia się strukturę cząsteczkową, co daje opłatę zwiększa rozpuszczalność, wpływa na właściwości białka. Przykładami są mleko fosfoproteinę kazeina i albumina jaja, ale głównie od kategorii białek kompleksujących są enzymy.
Fosforan grupa odgrywa ważną rolę funkcjonalną, jak wiele białek związanych z nim nie jest trwałe. W klatce cały czas procesów fosforylacji i defosforylacja występuje. W wyniku tego regulacja jest przeprowadzana w białkach. Na przykład, jeśli histonów – białka związane z kwasami nukleinowymi przebiega w stanie fosforylowanej, wówczas aktywność genomu (materiał genetyczny) wzrasta. Fosforylacją zależy od aktywności enzymów, takich jak glikogen i syntazy glikogenowej fosforylazy.
nukleoproteidu
Neuroptroteinach – białka związane z kwasami nukleinowymi. Są one – integralną część do przechowywania i regulacji materiału genetycznego pracy rybosomów, pełniącego funkcję syntezy białka. Najprostszą formą życia wirusa, można nazwać rybo- i dezoksiribonukleoproteinami, ponieważ są one wykonane z materiału genetycznego i białka.
Ponieważ oddziaływanie kwasu dezoksyrybonukleinowego (DNA) i histonu? W chromatyny izolowane dwa rodzaje białek związanych z DNA (histonów i niehistonowe). Pierwszym etapem w pierwszym zagęszczaniu DNA. Cząsteczka kwasu nukleinowego jest skręcona wokół białek z wytworzeniem nukleosomów. Gwint jest uformowany podobnie do kulek powstają struktury superskręcony (chromatyny włókienka) i supercoil (genonema interfazy). W wyniku działania białek histonowych i białek o wyższym poziomie dostarcza zmniejszenie wymiarów DNA tysięcy razy. Wystarczy w tym celu porównania wielkości i długości chromosomu kwasu nukleinowego, w celu oceny znaczenia białka (6-9 cm i 6,10 mikronów, odpowiednio).
Jakie są chromoproteins
Chromoproteins zawierać bardzo różne grupy, które są zjednoczeni tylko jedno – obecność koloru w składniku protetycznego. Złożone białka w tej kategorii są podzielone na: (hemoproteins zawierać strukturę hemu) retinalproteiny (witamina A) flawoprotein (witamina B2), kobamidproteiny (witamina B12).
Hemoproteins klasyfikowane według funkcji, na nie enzymatyczne (mioglobinovy hemoglobina i białko) i enzymów (cytochromów, katalazy, peroksydazy).
Flawoprotein zawierać protetycznych składowych pochodnych witaminy B2, mononukleotyd flawinowy (FMN) lub dinukleotyd flawinoadeninowy (FAD). Enzymy te są również zaangażowane w redoks przemian. Należą oksydoreduktazy.
Co jest Cytochromy?
Jak opisano powyżej, składa się z hemu porfiryny. Jego struktura składa się z czterech pierścieni pirolowych i żelaza dwuwartościowego. Szczególną grupą enzymów hemu – cytochromów, różniących się składem aminokwasów, a liczba łańcuchów peptydowych, wyspecjalizowane w przeprowadzaniu reakcji redoks, w wyniku czego jest zaopatrzona transferu elektronów w łańcuchu oddechowym. Te enzymy są zaangażowane w utlenianie mikrosomalną – początkowe reakcje biotransformacji ksenobiotyków, co prowadzi do ich zaniku, a przemiany wielu endogennych i egzogennych substancji, takich jak steroidy, nasyconych kwasów tłuszczowych.
Efekt grupa protetyczny
Grupa prostetyczną, który jest częścią kompleksu białko wpływa na jej właściwości: zmieniać swój ładunek, rozpuszczalność, termoplastyczność. Na przykład, takie działanie posiada reszty kwasu fosforowego lub monosacharydów. Część węglowodanów zawartych w kompleksie białko ochrony przed proteolizą (zniszczone przez hydrolizę) wpływa na wnikanie cząsteczek przez błonę komórkową, ich wydzielanie i sortowania. Ugrupowanie lipidu pozwala białko do tworzenia kanałów dla transportu słabo rozpuszczalne w wodzie (hydrofobowy) związków.
Struktura i funkcja białek kompleksujących są całkowicie zależne od grup prostetycznych. Na przykład, przy użyciu zawierających hemu żelaza w tlen hemoglobiny wiązanie występuje i dwutlenku węgla. Ze względu nukleoproteiny utworzone przez wzajemne oddziaływanie histony, protaminy DNA lub RNA zachodzi ochrony materiału genetycznego, jej czas przechowywania, proces wiązania RNA w syntezie białek. Nukleoproteiny zwane stabilne kompleksy białka i kwasów nukleinowych.
wniosek
Tak więc, białka kompleksu mają wiele różnych funkcji w organizmie. Dlatego spożywanie makro- i mikroelementów, tak ważne dla zdrowia. Metale są częścią wielu enzymów. Znając biochemia, zwłaszcza zdrowia i stanu środowiska zamieszkania, można ustawić tryb własnej mocy. Na przykład, terytorium odizolowany, charakteryzuje się niedoborem elementu. Jego dodatkowy wpis w diecie w postaci dodatków pozwala zrekompensować niedobór.
















